
正误判断,正确的划“√”,错误的划“×”
(1)1 L水中溶解5.85 g NaCl所形成的溶液的物质的量浓度是0.1 mol·L-1( )
(2)将25 g CuSO4·5H2O晶体溶于75 g水中所得溶质的质量分数为25%( )
(3)在100 mL的烧杯中,加入10 g食盐,然后注入90 mL的水,充分溶解后,所得溶质的质量分数为90%( )
(4)将40 g SO3溶于60 g水中所得溶质的质量分数为40%( )
(5)将62 g Na2O溶于水中,配成1 L溶液,所得溶质的物质的量浓度为1 mol·L-1( )
(6)T ℃时100 g饱和食盐水中,含有NaCl的质量为m g,则该温度时,NaCl的溶解度是m g( )
科目:高中化学 来源: 题型:
某期刊封面上的一个分子球棍模型图如图所示,图中“棍”代表单键、双键或三键,不同颜色的球代表不同元素的原子。该模型图可代表一种( )
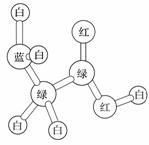
A.氨基酸 B.卤代羧酸
C.醇钠 D.酯
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有( )
A.15种 B.28种 C.32种 D.40种
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.乙醇和乙酸都是常用调味品的主要成分
B.75%(体积分数)的乙醇溶液常用于医疗消毒
C.乙醇和乙酸都能发生氧化反应
D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下图所示是合成香豆素过程中的中间产物,关于该物质的说法不正确的是( )
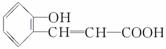
A.分子式为C9H8O3
B.有两种含氧官能团
C.1 mol该物质最多能与5 mol H2发生加成反应
D.该物质在一定条件下可能发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.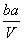 mol·L-1 B.
mol·L-1 B. mol·L-1
mol·L-1
C.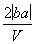 mol·L-1 D.
mol·L-1 D.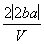 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
用“偏大”、“偏小”或“无影响”填空
(1)配制450 mL 0.1 mol·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8 g 。
(2)配制500 mL 0.1 mol·L-1的硫酸铜溶液,用托盘天平称取胆矾8.0 g 。
(3)配制NaOH溶液时,天平的两个托盘上放两张质量相等的纸片,其他操作均正确 。
(4)配制一定物质的量浓度的NaOH溶液,需称量溶质4.4 g,称量时物码放置颠倒 。
(5)用量筒量取浓硫酸时,仰视读数 。
(6)配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容 。
(7)定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度线 。
(8)定容摇匀后,发现液面下降,继续加水至刻度线 。
(9)定容时仰视刻度线 。
(10)定容摇匀后少量溶液外流 。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
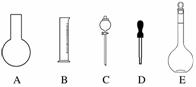
(1)如图所示的仪器中配制溶液肯定不需要的是
(填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为 g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度 (填“>”、“<”或“=”)0.1 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度 (填“>”、“<”或“=”)0.1 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为 (计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用 mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液不呈血红色 | 稀HNO3不能将Fe氧化为Fe3+ |
| B | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
| C | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和AgNO3溶液 | 均有固体析出 | 蛋白质均发生变性 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com