
【题目】钇钡铜氧、汞钡铜氧、汞钡钙铜氧等都是常见的高温超导体。回答下列问题:
(1)钇(39Y)是一种重要的稀土金属,基态Y原子的价电子排布式为______。下列科学家中,在稀土化学领域做出重要贡献的是_________(填标号)。
a.侯德榜 b.屠呦呦 c.徐光宪
(2)BaCO3可用于制备上述高温超导体,其3种组成元素中,第一电离能最大的是______(填元素符号),CO32-的空间构型为________,其中碳原子的杂化方式为________________。
(3)汞钡铜氧晶体的晶胞如下图A所示,通过掺杂Ca2+获得的具有更高临界温度的超导材料如图B所示。
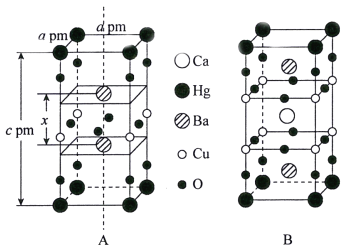
汞钡铜氧晶体的密度为______g·cm-3(设NA为阿伏加德罗常数的值)。图A晶胞中钡离子的分数坐标为(![]() )和_________。掺杂Ca2+所得超导材料的化学式为_________。
)和_________。掺杂Ca2+所得超导材料的化学式为_________。
【答案】4d15s2 C O (正)三角形 sp2 6.02×1032/a2cNA (1/2,1/2,(1-x)/2) HgBa2CaCu2O6
【解析】
(1)钇(39Y)为39号元素,基态Y原子的价电子排布式为:4d15s2,侯德榜创制侯氏制碱法,屠呦呦创制新型抗疟药青蒿素和双氢青蒿素,徐光宪发现了稀土溶剂萃取体系具有“恒定混合萃取比”基本规律,提出了适于稀土溶剂萃取分离的串级萃取理论,故稀土化学领域做出重要贡献的是徐光宪,故答案为:4d15s2;c;
(2)同周期,从左到右,第一电离能增大;同主族,从上到下,第一电离能减小,Ba、C、O中,第一电离能最大是O元素,CO32-中中心原子的价电子对数=孤电子对数+![]() 键=
键=![]() 键=0+3=3,所以空间构型为:正三角形,其中碳原子的杂化方式为:sp2,故答案为:O;正三角形;sp2;
键=0+3=3,所以空间构型为:正三角形,其中碳原子的杂化方式为:sp2,故答案为:O;正三角形;sp2;
(3)根据汞钡铜氧晶体的结构可知,晶胞中含有Hg有8×1/8=1个、Ba有2个、Cu有4×1/4=1个、O有8×1/4+4×1/2=4个,其密度为:![]() g·cm-3,图A晶胞中钡离子的分数坐标为(
g·cm-3,图A晶胞中钡离子的分数坐标为(![]() )和(
)和(![]() ),根据掺杂Ca2+所得超导材料的结构可知,晶胞中含有1个Ca、1个Hg、2个Ba、1个Cu、6个O,化学式为:HgBa2CaCu2O6,故答案为:
),根据掺杂Ca2+所得超导材料的结构可知,晶胞中含有1个Ca、1个Hg、2个Ba、1个Cu、6个O,化学式为:HgBa2CaCu2O6,故答案为:![]() ;(
;(![]() );HgBa2CaCu2O6。
);HgBa2CaCu2O6。


科目:高中化学 来源: 题型:
【题目】已知有位于元素周期表前四周期的元素X、Y、Z、T、W、Q,其部分信息如下表:
X | 宇宙中含量最丰富的元素 |
Y | 植物生长所必需的三种营养元素中,电负性最大的 |
Z | 原子最外层电子数是其电子层数的3倍 |
Q | 其气态氢化物与其低价氧化物常温下能反应,生成该元素的单质 |
T | 最高正价与最低负价代数和为6,其单质能与强碱溶液反应制消毒液 |
W | 其+2价阳离子的价电子排布为3d9 |
请回答下列问题:
(1)W元素位于周期表的第___周期___族,W2+能与X、Y形成的简单分子结合生成一种深蓝色的离子,其离子符号为___。
(2)X与Z按原子个数比为1:1组合得到的一种物质甲,它能用于杀菌消毒,物质甲的电子式为___;Q与T也能按原子个数比为1:1组合,得到一种暗黄色的液体乙,其结构与甲相似,则乙中存在的化学键类型有___和___;乙遇水发生歧化反应,得到一种淡黄色的固体和两种具有刺激性气味的气体,该反应的化学反应方程式为___。
(3)元素Q的简单离子半径___元素T的简单离子半径(填“>”“<”或“=”);元素T能形成多种含氧酸:HTO、HTO2、HTO3、HTO4,其酸性由强到弱的顺序为___(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与l00mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积己折算为标准状况下的体积)。下列分析正确的是

A. EF段,用盐酸表示该反应的平均反应速率为0.4mol/(L·min)
B. OE段表示的平均速率最快
C. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
D. F点收集到的CO2的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
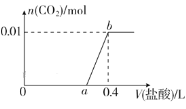
A.在0~a范围内,只发生中和反应
B.a=0.3
C.ab段发生反应的离子方程式为CO32-+2H+=CO2↑+H2O
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向100mL 0.1mol·L-1 NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH随NaOH溶液体积的变化如图所示。下列说法正确的是( )
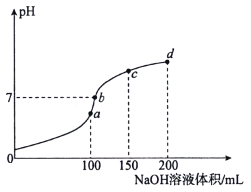
A.图中a、b、c、d四个点,水的电离程度最大的是d点
B.a点处存在c(NH4+)+c(NH3·H2O)=0.1mol·L-1
C.b点处存在c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.由b到c发生反应的离子方程式为NH4++OH-=NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置接口的连接顺序为___,加入药品前首先要进行的实验操作是___(不必写出具体的操作方法);其中装置B的作用是___。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯(一种有机化合物)中浸洗数次,该操作的目的是除去锂表面的石蜡,然后快速把锂放入到石英管中。通入一段时间氢气后加热石英管,在加热D处的石英管之前,必须进行的实验操作是___。
(3)加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。分析该反应原理,完成LiH与水反应的化学方程式___。
(4)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:

已知:还原焙烧主反应为2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:

根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________中加热;步骤C中的滤渣为__________。
(2)步骤D中氧化剂与还原剂的物质的量之比为__________。
(3)步骤E中调节pH的范围为____________,其目的是______________________________。
(4)步骤G,温度控制在35℃以下的原因是____________________________________,若Mn2+恰好沉淀完全时测得溶液中CO32-的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=____________。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是_____________________。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300 g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中NO3-完全转化为NO2-);加入稍过量的硫酸铵,发生反应NO2-+NH4+=N2↑+2H2O以除去NO2-;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-;用5.00 mL 0.500 mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________________________。
②试样中锰元素的质量分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是
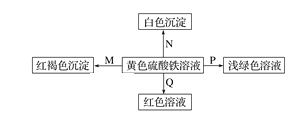
选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | KSCN |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
D | Na2O2 | MgCl2 | Fe | KSCN |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
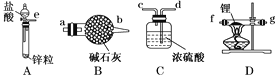
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com