
| A | B | C | D | |
| 用品 |  |  |  聚乙烯盒 |  |
| 成分 | (NH4)2SO4 | Na2CO3 |  | Fe2O3 |
| 用途 | 化肥 | 制玻璃 | 盛放食品 | 涂料 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.硫酸铵为铵盐含有氮元素,属于氨态氮肥;
B.石灰石、纯碱、二氧化硅为制造玻璃的原料;
C.聚乙烯,简称PE,无毒、无味、无臭,符合食品包装卫生标准,聚乙烯分子书写错误;
D.三氧化二铁为红棕色固体.
解答 解:A.硫酸铵为铵盐含有氮元素,属于氨态氮肥,是常用的一种化肥,故A正确;
B.制造玻璃的原料包括:石灰石、纯碱、二氧化硅,故B正确;
C.聚乙烯分子应为 ,故C错误;
,故C错误;
D.三氧化二铁为红棕色粉末,常用三氧化二铁生产红色颜料或是涂料,故D正确;
故选:C.
点评 本题考查了元素化合物知识,熟悉铵盐、碳酸钠、聚乙烯、三氧化二铁的性质及用途是解题关键,题目难度不大,注意对基础知识的积累.


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Ba2+、NO3-、NH4+、Cl- | B. | Mg2+、NH4+、SO42-、K+ | ||
| C. | K+、Ba2+、Cl-、HSO3- | D. | Ca2+、HCO3-、NH4+、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
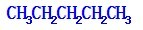 、
、 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于18s | B. | 等于12s | C. | 大于18s | D. | 小于18s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-) | |
| B. | 0.1 mol•L-1NaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-) | |
| C. | 等物质的量的NH4Cl和NaCl的混合溶液:c(NH4+)+c(NH3•H2O)+c(Na+)=2c(Cl-) | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的Na2CO3溶液:c(HCO3-)+c(H2CO3)=c(10-2-10-12) mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,用一充满氨气的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内氨水的物质的量的浓度为$\frac{1}{22.4}$ mol/L | |
| B. | 氨很容易液化,因此氨常用作制冷剂 | |
| C. | SO3溶于水能导电,所以SO3是电解质 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com