
 汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)
汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO,它们是现代化城市中的大气污染物.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g)| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol?L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| 1 |
| 2 |
| 1 |
| 2 |
| 10.0×10 -4mol/L-1.50×10 -4mol/L |
| 3s |
| ||
| (4.50×10 -4)?(9×10 -4)2 |
| (1.00×10 -4)?(2.7×10 -3)2 |
| ||


科目:高中化学 来源: 题型:
| A、同温同压下,相同体积的物质,其物质的量一定相等 |
| B、任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等 |
| C、1 L一氧化碳气体一定比1 L氧气的质量小 |
| D、相同条件下的一氧化碳气体和氮气,若物质的量相等则体积相等,但质量不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
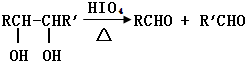
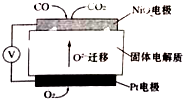
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.1 mol?L-1碳酸钠溶液中的阴离子总数为0.1NA |
| B、将400 mL 1 mol/L的HNO3溶液与7 g Fe粉充分反应,转移电子数为0.375NA |
| C、标准状况下,14 g氮气中共用电子对的数目为1.5NA |
| D、已知反应N2(g)+3H2(g)?2NH3(g)△H=-91.8KJ/mol中反应物的转化率为30%,相同条件下,当放出91.8 kJ热量时,生成氨分子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
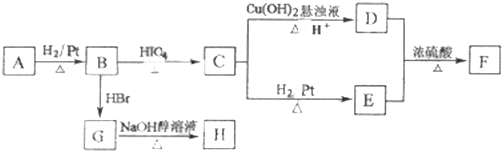
查看答案和解析>>
科目:高中化学 来源: 题型:
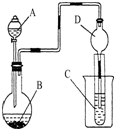
| A、若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B、若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊 |
| C、实验仪器D主要起到洗气的作用 |
| D、若A为浓氨水,B为生石灰,C中AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
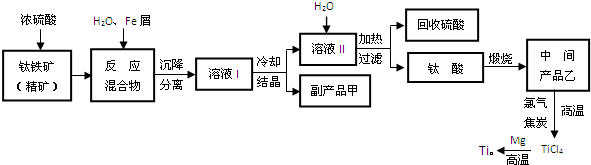
查看答案和解析>>
科目:高中化学 来源: 题型:
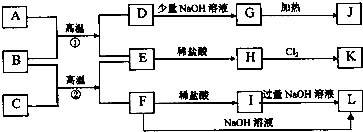
查看答案和解析>>
科目:高中化学 来源: 题型:
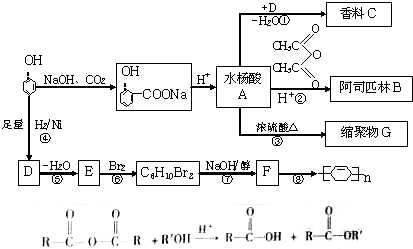
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com