
下列关于能量判据和熵判据的说法中,不正确的是( )
|
| A. | 放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程 |
|
| B. | 由能量判据和熵判据组合成的复合判据,将更适合于所有的过程 |
|
| C. | 在室温下碳酸钙的分解反应不能自发进行,但同样是这个吸热反应在较高温度(1200 K)下则能自发进行 |
|
| D. | 放热过程(△H<0)或熵增加(△S>0)的过程一定是自发的 |
考点:
反应热和焓变.
专题:
化学反应中的能量变化.
分析:
A.反应自发进行的判断依据是△H﹣T△S<0,物质的由固态变为气态,或生成的气体越多,则混乱度越大,熵值越大,反之越小,结合△S进行判断;
B.根据△H﹣T△S<0进行分析判断;
C.有些吸热反应在室温条件下不能自发进行,但在较高温度下则能自发进行;
D.放热过程(△H<0)或熵增加(△S>0)与过程是否自发无关.
解答:
解:A.反应自发进行的判断依据是△H﹣T△S<0,自发进行的反应也需要一定条件才可以发生,放热的自发过程,△H<0,△S可能小于0也可能大于0,所以,放热的自发过程可能是熵减小的过程,吸热的自发过程,△H>0,因T>0,须△H﹣T△S<0,取决于△S>0,所以吸热的自发过程一定为熵增加的过程,故A正确;
B.化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H﹣T•△S<0时,反应能自发进行,当△H<0,△S>0时,△G=△H﹣T•△S<0,一定能自发进行,而△H>0,△S<0时不能自发进行,△H>0,△S>0或△H<0,△S<0能否自发进行,取决于反应的温度,所以,由能量判据和熵判据组合成的复合判据,将更适合于所有的过程,故B正确;
C.在室温下碳酸钙的分解反应不能自发进行,△H﹣T△S>0,因△H>0,△S>0所以当反应温度高到一定程度,T△S>△H,此时△H﹣T△S<0,反应能自发进行,故C正确;
D.当△G=△H﹣T•△S<0时,反应能自发进行,当△H<0,△S>0时,△G=△H﹣T•△S<0,一定能自发进行,而△H>0,△S<0时不能自发进行,△H>0,△S>0或△H<0,△S<0能否自发进行,取决于反应的温度,故D错误;
故选D.
点评:
本题主要考查了反应热与焓变,注意△G=△H﹣T•△S的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
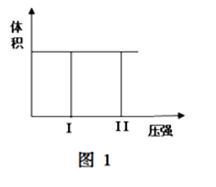
( I) 在一个容积固定不变的密闭容器中进行反应:
2X(g) + Y(g)  2Z(g) 若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。
2Z(g) 若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,
pC(g) ,
在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如
下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
⑴当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
⑵维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol.
⑶当压强为1×106 Pa时,此反应的平衡常数表达式: 。
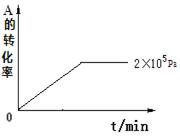
⑷其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是 ( )
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | pH=2与pH=1的硝酸中c(H+)之比为1:10 |
|
| B. | Na2CO3溶液中c(Na+)与c(CO32﹣)之比为2:1 |
|
| C. | 0.2 mol•L﹣1与0.1mol•L﹣1醋酸中c (H+)之比为2:1 |
|
| D. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列四个图象,下列反应中全部符合上述图象的反应是( )
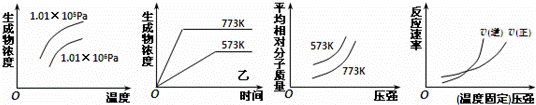
|
| A. | N2(g)+3H2(g)⇌2NH3(g);△H<0 |
|
| B. | 2SO3(g)⇌2SO2(g)+O2(g);△H>0 |
|
| C. | 4NH3(g)+5O2(g)⇌4NO+6H2O(g);△H<0 |
|
| D. | H2(g)+CO(g)⇌C(s)+H2O(g);△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学平衡原理在工农业生产中发挥着重要的指导作用.
(1)反应C(s)+CO2(g)⇌2CO(g)平衡常数K的表达式为 = ;已知C(s)+H2O(g)⇌CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)⇌CO(g)+H2O(g)的平衡常数为K2,则K与K1、K2二者的关系为 .
(2)已知某温度下,反应2SO2(g)+O2 (g)⇌2SO3(g),的平衡常数K=19,在该温度下的体积固定的密闭容器中充入C(SO2)=1mol•L﹣1,C(O2)=1mol•L﹣1,当反应在该温度下SO2转化率为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向 (填“正反应”或“逆反应”) 方向进行.
(3)对于可逆反应:aA(g)+bB(g)⇌cC(g)+dD(g)△H=a kJ•mol﹣1;若a+b>c+d,增大压强平衡向 (填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a 0(填“>”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中能大量共存的是( )
①pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
②无色溶液中:K+、Na+、MnO4﹣、SO42﹣
③加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、SO42﹣、NH4+
④含有Fe2+的溶液中:[Fe(CN)6]3﹣、NO3﹣、Cl﹣
⑤由水电离出的c(OH﹣)=1×10﹣13mol•L﹣1的溶液中:Na+、Ba2+、Cl﹣、Br﹣.
|
| A. | ①⑤ | B. | ②③ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)⇌NH3(g)+HI(g);②2HI(g)⇌H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L﹣1,c(HI)=4mol•L﹣1,则此温度下反应①的平衡常数为( )
|
| A. | 9 | B. | 16 | C. | 20 | D. | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在现代化学分析测试中,常借助一些仪器来分析化学物质的组成.下列有关说法不正确的是()
A. 用红外光谱仪确定物质中是否存在Na+、K+、Cu2+等离子
B. 用元素分析仪确定物质中是否含有C、H、O、N、S等
C. 用原子吸收光谱确定物质中含有哪些金属元素
D. 用pH计来测量溶液的酸碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com