
单质硅是很重要的工业产品。
(1)硅用于冶炼镁,也称硅热法炼镁。根据下列条件:
Mg(s)+ 1/2O2(g)= MgO(s) △H1=-601.8 kJ/mol
Mg(s)= Mg(g) △H2=+75 kJ/mol
Si(s) + O2(g) = SiO2(s) △H3= -859.4 kJ/mol
则2MgO(s)+ Si(s)= SiO2(s)+ 2Mg(g) △H =
Mg-NiOOH水激活电池是鱼雷的常用电池,电池总反应是:Mg+2NiOOH+2H2O=Mg(OH)2+ 2Ni(OH)2,写出电池正极的电极反应式 。
(2)制备多晶硅(硅单质的一种)的副产物主要是SiCl4,SiCl4对环境污染很大,遇水强烈水解,放出大量的热。研究人员利用SiCl4和钡矿粉(主要成分为BaCO3,且含有Fe3+、Mg2+等离子)制备BaCl2·2H2O和SiO2等物质。工艺流程如下:
已知: 25℃ Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mg(OH)2]=1.8×10-11;通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。回答下列问题:
①SiCl4发生水解反应的化学方程式为_______________________________________。
②若加钡矿粉调节pH=3时,溶液中c(Fe3+)= 。
③若用10吨含78% BaCO3的钡矿粉,最终得到8.4吨BaCl2·2H2O (M=244g/mol),则产率为 。
④滤渣C能分别溶于浓度均为3mol/L的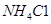 溶液和
溶液和 溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的
溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的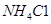 溶液的原因______。
溶液的原因______。
(1)+494.2kJ/mol, NiOOH + H2O + e- = Ni(OH)2 + OH-;
(2)①SiCl4 +3H2O = H2SiO3↓+ 4HCl 或SiCl4 + 4H2O = H4SiO4↓+ 4HCl
②4.0×10-5mol/L, ③ 86.9% (3分)
④Mg(OH)2(s)在溶液中存在的溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH- (aq),NH4+与OH-结合生成难电离的NH3.H2O,使平衡向正反应方向移动,最终Mg(OH)2溶解。(3分)
Mg2+(aq)+2OH- (aq),NH4+与OH-结合生成难电离的NH3.H2O,使平衡向正反应方向移动,最终Mg(OH)2溶解。(3分)
解析试题分析:(1)根据反应①Mg(s)+ 1/2O2(g)= MgO(s)△H1=-601.8 kJ/mol
②Mg(s)= Mg(g) △H2=+75 kJ/mol③Si(s)+ O2(g)= SiO2(s) △H3= -859.4 kJ/mol,利用盖斯定律:③+②×2—①×2得2MgO(s)+ Si(s)= SiO2(s)+ 2Mg(g) △H =+494.2kJ/mol;Mg-NiOOH水激活电池是鱼雷的常用电池,电池总反应是:Mg+2NiOOH+2H2O=Mg(OH)2+ 2Ni(OH)2,电池正极反应NiOOH得电子生成Ni(OH)2,利用原子守恒和电荷守恒写出电极反应式为
NiOOH + H2O + e- = Ni(OH)2 + OH-;(2)根据题给流程图知,SiCl4发生水解反应生成硅酸沉淀和盐酸,过滤得滤渣A为硅酸,滤液为盐酸,向滤液中加入钡矿粉(主要成分为BaCO3,且含有Fe3+、Mg2+等离子),调节至pH=7,过滤得滤渣B为氢氧化铁,向滤液中加氢氧化钠溶液,调节至pH=12.5,过滤得滤渣C为氢氧化镁,滤液经一系列操作得BaCl2·2H2O。①SiCl4发生水解反应生成硅酸和盐酸,化学方程式为SiCl4 +3H2O = H2SiO3↓+ 4HCl 或SiCl4 + 4H2O = H4SiO4↓+ 4HCl;②Ksp[Fe( OH)3]=4.0×10-38,pH=3的溶液中,氢氧根离子的浓度为1×10-11mol/L,c(Fe3+)=4.0×10-38/(1×10-11)3=4.0×10-5mol/L;③根据原子守恒得关系式:BaCO3——BaCl2·2H2O,若用10吨含78% BaCO3的钡矿粉,理论上生成BaCl2·2H2O为9.66吨,而最终得到8.4吨BaCl2·2H2O (M=244g/mol),则产率为86.9%;④根据题给信息知,滤渣氢氧化镁能溶于3mol/L的NH4Cl溶液的原因Mg(OH)2(s)在溶液中存在的溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH- (aq),NH4+与OH-结合生成难电离的NH3.H2O,使平衡向正反应方向移动,最终Mg(OH)2溶解。
Mg2+(aq)+2OH- (aq),NH4+与OH-结合生成难电离的NH3.H2O,使平衡向正反应方向移动,最终Mg(OH)2溶解。
考点:考查盖斯定律与焓变的计算、新型电池电极反应式书写、沉淀溶解平衡的相关计算、关系式法计算。


科目:高中化学 来源: 题型:填空题
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下: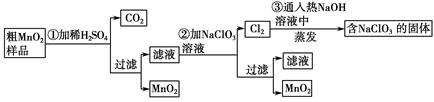
(1)第①步加稀H2SO4时,粗MnO2样品中的 (写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是 +
+ ClO3-+
ClO3-+ =
= MnO2↓+
MnO2↓+ Cl2↑+
Cl2↑+ 。
。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、 ,已知蒸发得到的固体中有NaClO3和NaOH,则一定还含有 (写化学式)。
(4)若粗MnO2样品的质量为12.69 g,第①步反应后,经过滤得到8.7 g MnO2,并收集到0.224 L CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温 度/℃ | - | - | 180 | 300 | 162 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据下列各题所给出的数据,可分别求出其“溶质的质量分数”或“溶质的物质的量
浓度”,试判断并求解。
(1)设NA表示阿伏加德罗常数的数值,若某氢氧化钠溶液V L中含有N个OH-,则可求出此溶液中______________________为__________________。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液中________为________。
(3)已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中__________为________。
(4)已知将100 mL氯化铝的水溶液加热蒸干灼烧,可得到白色固体b g,则可求出原氯化铝溶液中________为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题: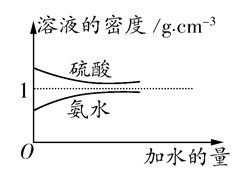
| | 溶质的物质的量 浓度(mol·L-1) | 溶液的密度(g·cm-3) |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
 c2 mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度
c2 mol·L-1的氨水等质量混合,所得溶液的密度 (填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度 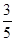 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
三氯化铁是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(1)将标准状况下的a L氯化氢气体溶于100 g水中,得到的盐酸的密度为
b g·mL-1,则该盐酸的物质的量的浓度是________。
向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为 ________。
(3)FeCl3溶液可以用来净水,其净水的原理为____________________ _____________________(用离子方程式表示),若100mL 2mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数________0.2NA(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1).等物质的量的CO和CO2中所含O原子个数之比 ,C原子数之比 ,二者的质量之比 。
(2)下列物质中:(1)Cu (2) Br2 ⑶Na2O ⑷蔗糖 ⑸NaCl溶液 ⑹ SO3 ⑺Ba(OH)2
属于电解质的是 , 属于非电解质的是 ,能导电的是 。(用序号填写)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫酸钠-过氧化氢加合物(xNa2SO4·yH2O2·zH2O)的组成可通过下列实验测定:①准确称取1.770 0 g样品,配制成100.00 mL溶液A。②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825 g。③准确量取25.00 mL溶液A,加适量稀硫酸酸化后,用0.020 00 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00 mL。H2O2与KMnO4反应的离子方程式如下:2MnO4—+5H2O2+6H+=2Mn2++8H2O+5O2↑
(1)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42—)≤1.0×10-6 mol·L-1,应保持溶液中c(Ba2+)≥________mol·L-1。
(2)上述滴定若不加稀硫酸酸化,MnO4—被还原为MnO2,其离子方程式为______________。
(3)通过计算确定样品的组成(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com