
| A. | 淀粉和纤维素 | B. | 油酸和丙烯酸 | ||
| C. | 三乙酸甘油酯和硬脂酸甘油酯 | D. | 甲酸乙酯、丙酸 |
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;互为同系物的物质满足以下特点:结构相似、化学性质相似、分子式通式相同、分子式不同、物理性质不同,研究对象是有机物;
具有相同分子式而结构不同的化合物互为同分异构体.
解答 解:A、淀粉和纤维素虽然化学式相同,但是聚合度n值不同,不是同分异构体,故A错误;
B、油酸和丙烯酸均为含有一个碳碳双键的不饱和一元酸,结构相似,分子组成上相差多个CH2原子团,属于同系物,故B正确;
C、三乙酸甘油酯和硬脂酸甘油酯,结构相似,分子组成上相差多个CH2原子团,属于同系物,故C正确;
D、甲酸乙酯和丙酸属于不同的物质类别,不是同分异构体,故D错误,故选BC.
点评 本题考查了同分异构体、同系物的判断,题目难度不大,注意掌握同系物、同素异形体、同分异构体的概念及区别,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 1对 | B. | 2对 | C. | 3对 | D. | 4对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列关于咖啡酸的说法不正确的是( )
咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列关于咖啡酸的说法不正确的是( )| A. | 咖啡酸的分子式为C9H8O4 | |
| B. | 1mol咖啡酸可以和含4molBr2的浓溴水反应 | |
| C. | 1mol咖啡酸可以和3molNaOH反应 | |
| D. | 可以用高锰酸钾检验出咖啡酸分子中含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H4 | C. | C2H6 | D. | C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl | B. | ${\;}_{21}^{40}$K和${\;}_{20}^{40}$Ca | ||
| C. | O2和O3 | D. | H2O和D2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 化学反应 | 离子方程式 | 评价 |
| ① | 硫酸溶液中加入Ba(OH)2溶液 | Ba2++SO42-═BaSO4↓ | 正确 |
| ② | 氧化铝与NaOH溶液反应 | 2Al3-+302-+20H- ═2AlO2-+H20 | 错误,Al203不应写成离子 形式 |
| ③ | 铁和足量稀硝酸反应 | Fe+2H+═H2↑+Fe2+ | 正确 |
| ④ | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | 错误,离子方程式中Fe2+与Br-的物质的量之比与化学式不符 |
| A. | ① | B. | ①③ | C. | ②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
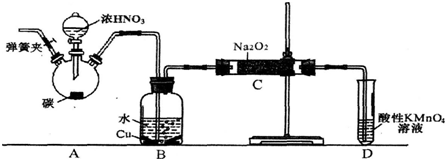
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用完的电池不可以随意地丢弃 | |
| B. | 增加炼铁高炉的高度可以降低尾气中CO的含量 | |
| C. | 加入催化剂可以大大提高化学反应速率 | |
| D. | 把煤粉碎后再燃烧可以提高煤的燃烧效率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com