
| A. | 18gH2O 中含有的质子数是 10NA | |
| B. | 1mol 臭氧和 1mol 氧气含有相同的氧原子数 | |
| C. | 46g NO2 和 N2O4混合气体中含有的原子总数为 3NA | |
| D. | 等物质的量的干冰和葡萄糖中所含的碳原子数之比为 1:6,氧原子数之比为 1:3 |
分析 A.质量转化为物质的量结合1个水分子含有10个质子解答;
B.依据臭氧、氧气的分子式计算氧原子数;
C.NO2和N2O4的最简式相同为NO2,计算46g NO2中所含原子数;
D.干冰分子式是CO2,葡萄糖分子式是C6H12O6,等物质的量的干冰和葡萄糖中所含碳原子数之比等于分子式碳原子数目之比、氧原子数之比等于分子式中氧原子数目之比.
解答 解:A.18gH2O 物质的量为$\frac{18g}{18g/mol}$=1mol,含有的质子数是 10NA,故A正确;
B.1mol 臭氧含有3mol氧原子,1mol 氧气含有2mol氧原子,二者含有氧原子数目不相同,故B错误;
C.NO2和N2O4的最简式相同为NO2,计算46g NO2中所含原子数=$\frac{46g}{46g/mol}$×3×NA=3NA,故C正确;
D.干冰分子式是CO2,葡萄糖分子式是C6H12O6,等物质的量的干冰和葡萄糖中所含碳原子数之比为1:6,所含氧原子数之比为2:6=1:3,故D正确;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
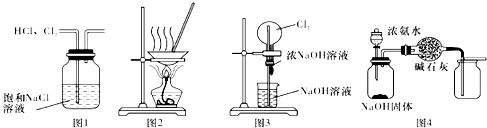
| A. | 用图1所示装置除去HCl中含有的少量Cl2 | |
| B. | 用图2所示装置将硫酸铜溶液蒸干,制备胆矾 | |
| C. | 用图3所示装置可以完成“喷泉”实验 | |
| D. | 用图4所示装置制取并收集干燥纯净的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CO2含有2NA个氧原子 | |
| B. | 1 mol•L-1 NaOH溶液中含有NA个Na+ | |
| C. | 标准状况下,22.4L CCl4中含有NA个CCl4分子 | |
| D. | 常温常压下,28g氮气所占的体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用一次性筷子,既方便又卫生,且耗木才不多、应提倡大量使用 | |
| B. | 塑料像把双刀剑,它既可极大地方便人们的生活,又给环境带来污染 | |
| C. | 甲烷是优良的气体燃料,但矿井里由于它的存在,在通风不良时,易发生爆炸 | |
| D. | 大气中CO2的浓度不断上升,使全球变暖,但同时也有利于植物光合作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在标准状况下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )| A. | 2:7 | B. | 5:4 | C. | 4:5 | D. | 7:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用中和法除去废水中的酸 | B. | 用混凝剂除去废水中的重金属离子 | ||
| C. | 用氯气除去废水中的悬浮物 | D. | 用臭氧除去废水中的异味 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
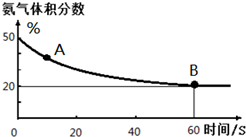 尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com