
| A. | 图为丙烷的球棍模型: | B. | 某有机物的名称是:2,3二甲基戊烷 | ||
| C. | 乙烯的结构简式CH2CH2 | D. | 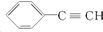 的最简式为:C4H3 的最简式为:C4H3 |
分析 A.根据丙烷的分子组成、结构特点及球棍模型的表示方法进行判断;
B.2,3-二甲基戊烷符合烷烃的系统命名法规则;
C.乙烯的结构简式中没有标出其官能团碳碳双键;
D.最简式指用元素符号表示化合物分子中各元素的原子个数比的最简关系式.
解答 解:A.丙烷为含有3个碳原子的烷烃,丙烷的球棍模型为 ,故A正确;
,故A正确;
B.2,3二甲基戊烷主链含有5个,从离甲基最近的一端,及左边开始编号,结构简式为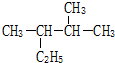 ,故B正确;
,故B正确;
C.乙烯的官能团为碳碳双键,结构简式中需要标出官能团,乙烯的结构简式为CH2=CH2,故C错误;
D. 的分子式为C8H6,最简式为:C4H3,故D正确;
的分子式为C8H6,最简式为:C4H3,故D正确;
故选C.
点评 本题考查了球棍模型、系统命名、结构简式、最简式的表示方法及判断,题目都能不大,注意掌握常见的化学用语的概念及正确的表示方法,明确比例模型与球棍模型的概念及区别.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 22.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/LHCl溶液混合后溶液呈酸性,所得溶液中: c(CH3COOH)>c(Cl-)>c(CH3COO-)>c(H+) | |
| B. | 等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )+c(OH-) | |
| D. | 草酸钠(Na2C2O4)溶液中:c(OH-)=c(H+)+c(HC2O4)+c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
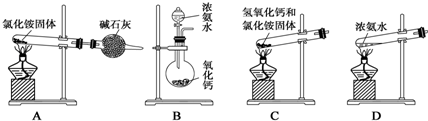
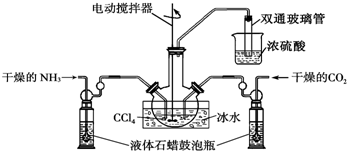
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g二氧化硅晶体中,含共价键NA个 | |
| B. | 常温常压下,22.4L H2中含质子数为2NA个 | |
| C. | 含0.5mol硫酸钠的溶液中离子总数为3NA个 | |
| D. | 0.5mol镁与足量的盐酸完全反应,将失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com