
铜锈是一种绿色化合物,它的成分为碱式碳酸铜,兼有氢氧化铜和碳酸铜的性质。试推测:铜锈在高温灼烧条件下充分反应后的固体物质是( )
A.黑色的氧化铜
B.红色的氧化亚铜
C.蓝色的氢氧化铜和碳酸铜
D.黑色的氧化亚铜
科目:高中化学 来源: 题型:
进行一氯取代后,只生成三种沸点不同的产物的烷烃是
A.(CH3)2CHCH2CH2CH3 B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2 D.(CH3)3CCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_____________________________,发生 反应(填氧化或还原);电子从 经外电路到 (填锌或铜),溶液中H+ 向 移动(填正极或负极)。
(2)根据反应2Fe3+ + Cu = 2Fe2++Cu2+ 设计原电池,所需负极材料为 ,溶液中Fe3+向 (填“负极”或“正极”)迁移,负极反应式为 ;正极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质的方法不正确的是 ( )。
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.用过量氨水除去Fe3+溶液中的少量Al3+
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组用铝土矿(主要成分为Al2O3,还含有SiO2及铁的氧化物)提取氧化铝做冶炼铝的原料,提取的操作过程如下:
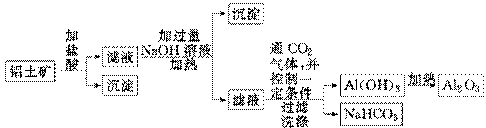
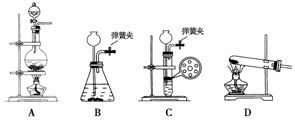
(1)实验室中制取CO2时,为了使反应随开随用、随关随停,应选用下图中的装置________(填字母代号)。
(2)在过滤操作中,除烧杯、玻璃棒外,还需用到的玻璃仪器有
________________________;洗涤沉淀的操作是
__________________ ______________________________________________________。
______________________________________________________。
(3)实验室制备氢氧化铝的方案有多种。现提供铝屑、氢氧化钠溶液、稀硫酸三种药品,若制备等量的氢氧化铝,请你从药品用量最少的角度出发,设计出最佳实验方案(方案不必给出),写出此方案中发生反应的离子方程式:
________________________________________________________________________
________________________________________________________________________。
此方案中所用药品的物质的量之比是:n(Al)∶n(H2SO4)∶n(NaOH)=________。
(4)兴趣小组欲对铝土矿中铁元素的价态进行探究:取少量固体,加入过量稀硝酸,加热溶解;取少许溶液滴加KSCN溶液后出现红色。由此得出,铁元素的价态为+3的结论。请指出该结论是否合理并说明理由______________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422
℃,沸点1366 ℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO 等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如下:
等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如下:
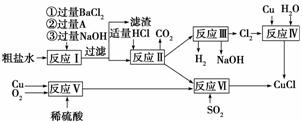
(1)A的化学 式为________。
式为________。
(2)写出反应Ⅴ的化学方程式________________________________________________
________________________________________________________________________。
(3)写出反应Ⅵ的离子方程式_____________________________________________
________________________________________________________________________。
(4)本工艺中可以循环利用的物质是(用化学式表示)_______________________________
________________________________________________________________________。
(5)反应Ⅵ后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃ 干燥2小时,冷却,密封包装即得产品。于70 ℃真空干燥的目的是_______
干燥2小时,冷却,密封包装即得产品。于70 ℃真空干燥的目的是_______ ____________
____________
___________________________________ ___________________
___________________ __________________。
__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物的应用范围很广。下列说法正确的是 ( )。
A.硅是人类将太阳能转换为电能的常用材料
B.粗硅制备单晶硅不涉及氧化还原反应
C.反应:Si+2NaOH+H2O===Na2SiO3+2H2↑中,Si为还原剂,NaOH和H2O为氧化剂
D.硅能与氢氟酸反应,则硅可以与盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是常见的不同主族的短周期元素,它们的原子序数逐渐增大。已知其中只有一种是金属元素,C元素原子最外层电子数是D元素原子的最外层电子数的一半,B元素原子的最外层电子数比D元素原子的最外层电子数少2个。E、F也是短周期元素,E与D同主族,F与A同主族。
(1)写出F2E2的电子式:____________________________________________,
其化学键类型为____________________。
( 2)六种元素中的三种组成的易溶于水的酸性物质中,能促进水电离的物质M是________________________________________________________________
2)六种元素中的三种组成的易溶于水的酸性物质中,能促进水电离的物质M是________________________________________________________________
(写化学式,写一个即可,下同),能抑制水电离的物质N是________。
25 ℃时,pH=a的M溶液中由水电离出的H+浓度与pH=a的N溶液中由水电离出的H+浓度之比为________。
(3)甲、乙、丙分别是B、C、D三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙的用量不同,反应的产物不同。回答下列问题:
①向乙溶液中缓慢滴加过量的丙溶液,过程中发生反应的离子方程式为_______________________________ ___________________________________。
___________________________________。
②向甲溶液中缓慢滴加过量的丙溶液,所观察到的实验现象为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com