
| A. | 0.1molNaHSO4固体中含有的阳离子数目为0.1NA | |
| B. | 常温常压下,3.2gN2H4中含有的极性共价键数目为0.1NA | |
| C. | 25℃时,pH=12的Ba(OH)2溶液中含OH-的数目为0.01NA | |
| D. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
分析 A.硫酸氢钠固体中阳离子为钠离子,依据质量换算物质的量计算微粒数;
B.物质的量n=$\frac{m}{M}$,结合N2H4中化学键分析,极性共价键为N-H键;
C.溶液体积不知不能计算氢氧根离子数目;
D.二氧化锰只能与浓盐酸反应,和稀盐酸不反应.
解答 解:A.硫酸氢钠固体中阳离子为钠离子,阴离子为HSO4-,NaHSO4固体物质的量为0.1mol,含有的阳离子数目为0.1 NA,故A正确;
B.3.2gN2H4物质的量n=$\frac{3.2g}{32g/mol}$=0.1mol,1个N2H4分子中N-H键为极性键有4个,0.1molN2H4中含有的极性共价键数目为0.4NA,故B错误;
C.溶液体积不知,pH=12的Ba(OH)2溶液中只能知道氢氧根离子浓度,不能计算氢氧根离子数,故C错误;
D.二氧化锰只能与浓盐酸反应,和稀盐酸不反应,即盐酸不能反应完全,故转移的电子数小于0.3NA个,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,主要是微粒结构的分析和溶液浓度的变化,熟练掌握公式的使用和物质的结构是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
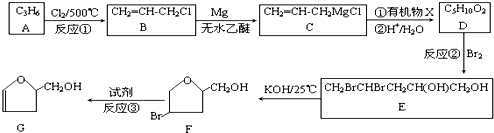
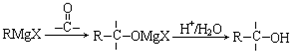
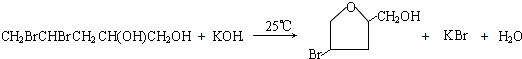 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 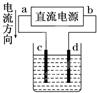 装置用来电解饱和食盐水,c电极产生的气体能使湿润的淀粉KI试纸变蓝 | |
| B. | 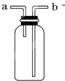 装置可用于收集H2、NH3、Cl2、HCl、NO2 | |
| C. | 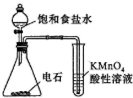 装置检查乙炔的还原性 | |
| D. | 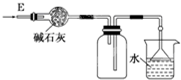 装置可用于干燥、收集氨气、并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事实 | 现象 | 解释 | |
| A | 氯化铁溶液中滴加少量氢硫酸 | 产生黄色浑浊 | 2Fe3++H2S=2Fe2++S↓+2H+ |
| B | Fe(NO3)2溶液加稀盐酸 | 溶液绿色加深 | Fe2++H2O?Fe(OH)2+2H+ 抑制了水解,浅绿色加深 |
| C | 已知CH4的燃烧热为890kJ/mol | 甲烷用作燃料,1.6g CH4完全燃烧,放热89kJ | CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol |
| D | Mg(OH)2悬浊液中滴加FeCl3溶液至Mg(OH)2几乎完全反应 | 白色沉淀变为红褐色沉淀 | $\frac{{k}_{sp}^{3}[Mg(OH)_{2}]}{{k}_{sp}^{2}[Fe(OH]_{3}]}$<105 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
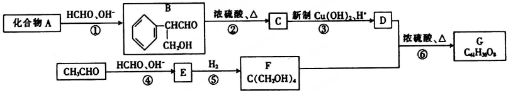
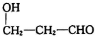
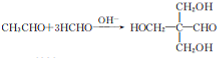 .
.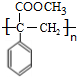 (填结构简式).
(填结构简式).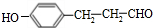 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 解释与结论 |
| A | 向某溶液中加入BaCl2溶液 | 有白色沉淀产生 | 生成了难溶于水的BaSO4,该溶液中一定含有SO42- |
| B | 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量稀NaI溶液 | 开始有白色沉淀生成,后有黄色沉淀生成 | Ksp(AgI)<Ksp(AgCl) |
| C | 向苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 苯和溴水发生取代反应,使溴水褪色 |
| D | 向蔗糖中加入浓硫酸 | 变黑,放热,体积膨胀,放出刺激性气体 | 浓硫酸具有吸水性和强氧化性,反应中生成C、SO2和CO2等 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、SO42-、NH3•H2O | B. | Na+、OH-、Cl2 | ||
| C. | K+、Ca2+、CO32- | D. | H+、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
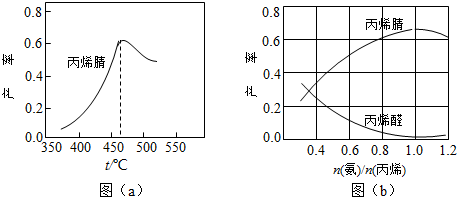
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com