
【题目】下列物质中属于纯净物、化合物、无机化合物、盐、钙盐的是( )
A.石灰石
B.Ca(OH)2
C.CaCO3
D.CH4
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向浓度均为l×10-3mol/L的KCl和K2CrO4混合液中滴加l×10-3mol/LAgNO3溶液,CrO42-先形成沉淀
C. 碳酸钠溶液中滴加少量氯水的离子方程式为CO32-+Cl2+H2O=HCO3-+Cl-+HClO
D. 向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的性质呈现周期性变化的根本原因是
A. 原子半径呈周期性变化
B. 元素的化合价呈周期性变化
C. 第一电离能呈周期性变化
D. 元素原子的核外电子排布呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe3+、CO32﹣、SO42﹣、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 原溶液一定存在CO32﹣和SO42﹣,一定不存在Fe3+
B. 原溶液一定存在Cl﹣,可能存在Na+
C. 原溶液中c(Cl﹣)≥0.1molL﹣1
D. 若原溶液中不存在Na+,则c(Cl﹣)<0.1molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的同系物的命名说法中错误的是( )
A.苯的同系物命名必是以苯作为母体,其他的基团作为取代基
B.二甲苯可以以邻、间、对这种习惯方法进行命名
C.二甲苯也可以用系统方法进行命名
D.化学式是C8H10的苯的同系物有4种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属,以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
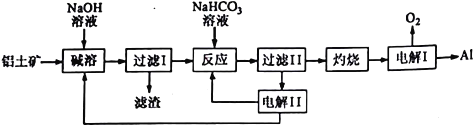
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)A1的原子结构示意图为_______________;A1与NaOH溶液反应的离子方程式为______________________________________。
(2) “碱溶”时生成偏铝酸钠的离子方程式为_______________________________。
(3)向” 过滤Ⅰ所得滤液中加入NaHCO3溶液,溶液的pH_________(填“增大”、“ 不变”或“减小”)。
(4) “电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是__________________。
(5)”电解Ⅱ原理如图所示。
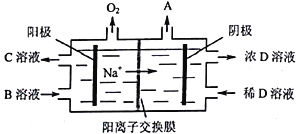
①试写出A、B、C、D物质的化学式:A_______,B_______,C_______,D_______。
②阳极的电极反应式为______________________________。
(6)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是:
A. CO2分子的球棍模型:![]() B. 14N 的原子结构示意图:
B. 14N 的原子结构示意图:![]()
C. CH4分子的比例模型:  D. 质子数为6,中子数为8 的核素:l4C
D. 质子数为6,中子数为8 的核素:l4C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的体检指标中,表示总胆红素指标的物理量是( )
项目名称 结果 单位 参考值
1谷丙转氨酶 7 U/L <40
2谷草转氨酶 16 U/L 0-40
3谷酰转肽酶 15 U/L 0-50
4碱性磷酸酶 77 U/L 34-114
5总胆红素 12.3 mmol/L 0-19
A.质量分数B.溶解度C.摩尔质量D.物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过实验研究钠及其化合物的有关性质,请回答相关问题.
(1)实验室中少量的钠通常保存在_______中,在实验室中取用钠的仪器是________.
(2)若将钠在空气中加热,钠会燃烧发出黄色火焰,同时生成 色的固体,写出该产物与H2O反应的化学方程式:________.
(3)将金属钠投入水中,发生反应的离子方程式为________
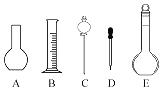
(4)该同学在实验室欲配制500mL0.1mol/L NaOH溶液.
①配制溶液时肯定不需要如图所示仪器中的________(填字母),配制上述溶液还需要用到的玻璃仪器是________(填仪器名称).
②根据计算,该同学应用托盘天平称取NaOH的质量为________.
③该同学将所配制的NaOH溶液进行测定,发现浓度大于0.1mol/L.下列操作会引起所配浓度偏大的是________.
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com