
| A. | 既能与酸反应,又能与碱反应 | |
| B. | 导电性好 | |
| C. | 熔点低 | |
| D. | 具有还原性,在冶炼反应中放出大量的热量 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
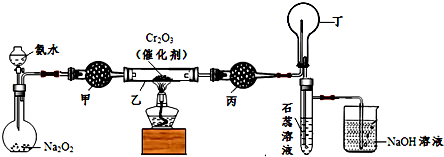
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
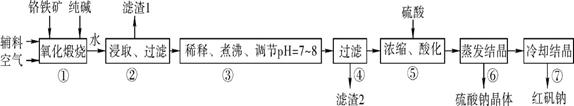
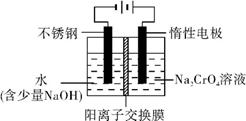
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2因导电能力强而用于制造通讯光缆 | |
| B. | 用秸秆中的纤维素直接水解制取燃料乙醇 | |
| C. | 处理废水时,加入明矾作为消毒剂除去水中的细菌 | |
| D. | 硅胶可作袋装食品的干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
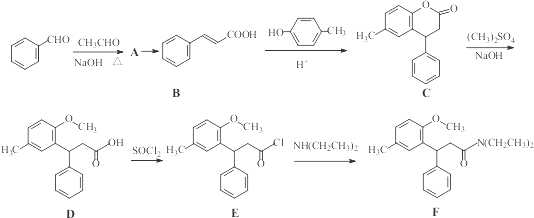
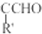
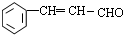 .
.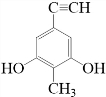 等.(任写一种)
等.(任写一种)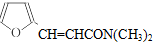 )是一种高效麻醉剂,写出以
)是一种高效麻醉剂,写出以 、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图示例如下:
、CH3CHO、NH(CH3)2为原料制备呋喃丙胺的合成路线流程图(无机试剂自选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 AgNO3溶液:H+、K+、SO42-、I- | |
| B. | 使甲基橙变红的溶液中:Fe2+、Al3+、NO3-、Cl-、S2- | |
| C. | $\frac{Kw}{c(H+)}$=0.1 mol•L-1的溶液:Na+、K+、SiO32-、AlO2- | |
| D. | 与铝反应产生大量H2的溶液中:Na+、NH4+、C6H5O-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
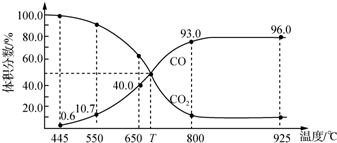
| A. | 550℃时,若充入惰性气体,v(正)、v(逆)均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 925℃时,此反应的平衡常数K=2 304,保持温度不变,若缩小体积,K值将变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某条件下可逆反应达到限度之前,逆反应速率逐渐增大可能与生成物浓度逐渐增大有关 | |
| B. | 可逆反应的限度不随反应条件的改变而改变 | |
| C. | 化学反应的限度决定了反应物在该条件下的最大转化率 | |
| D. | 炼铁高炉尾气中CO含量不随高炉高度改变而改变,是因为有关反应达到了限度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com