
【题目】羟基香茅醛是一种日化香料,主要用于配制柑桔、西瓜、樱桃等瓜果型香精,其结构简式如图所示。请回答下列问题:
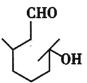
(1)羟基香茅醛的分子式为___,按系统命名法写出其名称:___,其中含有的官能团有___。
(2)观察羟基香茅醛的结构简式,请判断该有机化合物不能发生的反应是___(填序号)。
A.酯化反应 B.加成反应 C.消去反应 D.水解反应 E.银镜反应
【答案】C10H20O2 3,7-二甲基-7-羟基辛醛 羟基、醛基 D
【解析】
(1)依据碳呈四价的原则,可数出分子中的各原子数,由此得出羟基香茅醛的分子式,也可与同数碳原子的烷烃相比较,数出碳原子数,计算所含氢原子数;给羟基香茅醛按系统命名法命名时,先确定主官能团,然后从醛基开始进行编号,依据名称的书写原则进行书写。
(2)观察羟基香茅醛的结构简式,确定官能团,依据官能团的性质进行选择。
(1)羟基香茅醛的分子中含有10个碳原子,与同数碳原子的烷烃比,氢原子数应为10×2+2-2=20,由此得出分子式为C10H20O2;羟基香茅醛的主官能团为醛基,以醛基碳原子为第一碳原子,然后确定两个甲基的位置为3、7,羟基的位置为7,从而写出其名称为3,7-二甲基-7-羟基辛醛,其中含有的官能团有羟基、醛基。答案为:C10H20O2;3,7-二甲基-7-羟基辛醛;羟基、醛基;
(2)A.羟基香茅醛分子中含有-OH,能发生酯化反应,A不合题意;
B.羟基香茅醛分子中含有醛基,能发生加成反应,B不合题意;
C.羟基香茅醛分子中含有-OH,且相邻碳原子上连有氢原子,能发生消去反应,C不合题意;
D.羟基香茅醛分子中不含有能水解的酯基、卤原子等,不能发生水解反应,D符合题意;
E.羟基香茅醛分子中含有醛基,能发生银镜反应,E不合题意;
故选D。答案为:D。


科目:高中化学 来源: 题型:
【题目】铜铟镓硒薄膜太阳能电池(GIGS)是第三代太阳能电池的典型代表,已成为全球光伏领域研究的热点之一,回答下列问题:
(1)镓(Ga)价电子排布式为______,镓(Ga)与铟(In)同主族第一电离能较小的为______(用元素符号表示)。
(2)硒属于_______区元素。O、S、Se简单氢化物稳定性由強到弱的顺序为______,中心原子的杂化方式为___________,键角最大的是_____________。
(3)已知N-N、N=N键能之比为l:4.9,而C-C、C=C键能之比为1:2.34。则N2和C2H2中叁键能较大的是__________ (填化学式)。
(4)某晶体的晶胞结构如图所示(在该晶体中通过掺入适量的Ga以替代部分In就可以形GIGS晶体),该晶体的化学式为__________。

图中A原子和B原子坐标(分别为(0,0,0),(0,0, ![]() ),则C原子坐标为_________。
),则C原子坐标为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.10 mol镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为( )
A. 3.2 g B. 4.0 g C. 4.2 g D. 4.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A.lmolC3H8O分子中含有共价键数目为11NA
B.一定条件下,将2.8gN2与足量氢气充分反应,得到氨气分子数目等于0.2NA
C.标准状况下,22.4LSO2和SO3的混合物,含硫原子的数目为NA
D.15g14C16O中含有的质子数目为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱水环化是合成生物碱类天然产物的重要步骤,某生物碱V合成路线如图:

(1)Ⅳ中官能团的名称___;反应①的反应类型为___。
(2)反应②的化学方程式__。
(3)Ⅰ和Ⅲ在浓硫酸催化加热时反应的化学方程式___。
(4)下列说法正确的是___。
A.Ⅰ和Ⅴ均属于芳香烃 B.Ⅱ能发生银镜反应
C.Ⅱ能与4molH2发生加成反应 D.反应③属于酯化反应
(5)A的结构简式__。
(6)Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种。写出满足上述条件的Ⅵ的结构简式___。
(7)一定条件下,化合物Ⅶ(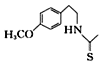 )也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式___。
)也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含Ti化合物在工业生产中有着重要用途。TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
nCH3CH=CH2 ![]()
![]()
TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
(1)Ti3+的基态核外电子排布式为__________;
(2)丙烯分子中,碳原子轨道杂化类型为__________;
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________;
(4)写出一种由第2周期元素组成且与CO互为等电子体的阴离子的电子式____;
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______;
(6)钛酸锶具有超导性、热敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置(如图),据此推测,钛酸锶的化学式为_________。
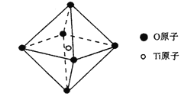
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示。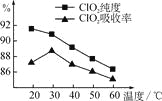
(1) 据图可知,反应时需要控制的适宜温度是________℃,要达到此要求需要采取的措施是______________。
(2) 已知:黄铁矿中的硫元素在酸性条件下可被ClO3-氧化成SO42-,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式:______________________。
(3) 该小组拟以“![]() ”作为衡量ClO2产率的指标。若取NaClO3样品6.0 g,通过反应和吸收获得400 mL ClO2溶液,取此溶液20 mL与37.00 mL 0.500 mol·L-1(NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0 mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00 mL。反应原理为:4H++ClO2+5Fe2+=Cl-+5Fe3++2H2O;14H++Cr2O72-+6Fe2+=2Cr3++6Fe3++7H2O;
”作为衡量ClO2产率的指标。若取NaClO3样品6.0 g,通过反应和吸收获得400 mL ClO2溶液,取此溶液20 mL与37.00 mL 0.500 mol·L-1(NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0 mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00 mL。反应原理为:4H++ClO2+5Fe2+=Cl-+5Fe3++2H2O;14H++Cr2O72-+6Fe2+=2Cr3++6Fe3++7H2O;
试计算ClO2的“产率” _______________ (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有___离子,滤渣中含有___;在溶解过滤时使用的仪器有___。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式____。
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为____。
(5)计算该样品中铝的质量分数的表达式为___。
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果___(“偏高”“偏低”或“无影响”,下同)。若第(4)步对沉淀的灼烧不充分时,会使测定的结果___。若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com