
二氧化氯是黄绿色的气体,可用于水体消毒与废水处理。一种制备方法为:
__H2C2O4 +__NaClO3 +__H2SO4 →__Na2SO4+__CO2↑ +__ClO2↑ +__H2O
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是__________________________。
(2)该反应每产生0.2 mol ClO2,需要消耗草酸晶体(H2C2O4·2H2O)_________g。
(3)上述反应物中属于第三周期的元素的原子半径大小顺序__________________________,
其中原子半径最大的元素最外层电子云形状为___________________________。
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与__________相同。(写一种)
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:_______________________________________________。
(6)上述反应产物NaCl中含有 __________键,工业上用电解熔融的氯化钠制备金属钠,氯气在_________(写电极名称)产生。
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
A是芳香烃的含氧衍生物。为了测定其分子组成,进行如下实验:
①在一定温度和压强下将A气化,其气体的质量是同温、同压下等体积氦气质量的38倍;②称取7.6gA,在11.2L氧气中完全燃烧,其产物只有CO2和水蒸气。将反应后的混合气 通过浓硫酸后体积为10.64L,浓H2SO4质量增加3.6g。再将余下的气体通过盛有足量Na2O2的干燥管后,气体体积减少至6.16L(气体体积均在标准状况下测定)。试回答:
(1)A的分子式为 ;
(2)A物质苯环上只有一取代基,遇FeCl3溶液无显色反应。1molA只能与1molNaHCO3反应;1molA与足量Na反应生成1molH2。则A的结构简式为 ;
(3)A与足量钠反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
五种短周期元素的某些性质如表所示(其中Z、M、W为同周期元素)。
| 元素代号 | Y | X | W | M | Z |
| 原子半径(×10-12 m) | 64 | 73 | 78 | 96 | 113 |
| 主要化合价 | -1 | +5、-3 | +7、-1 | +4、-4 | +3 |
下列说法不正确的是( )
A.由M与W形成的化合物是含有极性键的极性分子
B. X与M之间形成的化合物,其晶体是原子晶体
C.由M元素形成的晶体,是太阳能光伏发电的主要材料,工业上制取M单质,可通过置换反应原理来生产
D.Y与Z元素形成的[ZY6]3-,离子中存在配位键,该离子构型呈正八面体
查看答案和解析>>
科目:高中化学 来源: 题型:
普罗帕酮为广谱高效膜抑制性抗心律失常药。其合成路线如下:
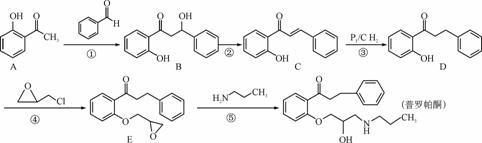
(1) 化合物C的含氧官能团为________和________(填官能团的名称)。
(2) 反应①→④中属于加成反应的是________(填序号)。
(3) 写出同时满足下列条件的A的同分异构体结构简式:________。
Ⅰ. 分子中含有苯环,且苯环上的一氯代物有两种;
Ⅱ. 与FeCl3溶液发生显色反应;
Ⅲ. 能发生银镜反应。
(4) 产物普罗帕酮中会混有少量副产物F(分子式为C21H27O3N)。F的结构简式为________。
(5) 化合物3羟基戊二酸二乙酯(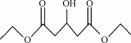 )是一种医药中间体,请结合流程信息,写出以丙酮、乙醇和甲醛为原料,制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
)是一种医药中间体,请结合流程信息,写出以丙酮、乙醇和甲醛为原料,制备该化合物的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
H2C==CH2 CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各图示实验设计和操作合理的是 ( )
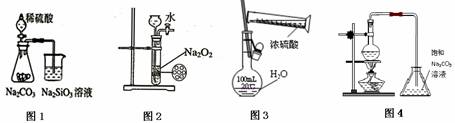
A.图1 证明非金属性强弱:S>C>Si B.图2 制备少量氧气
C.图3 配制一定物质的量浓度的硫酸溶液 D.图4 制备少量乙酸丁酯
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质分类或归纳正确的是
①混合物:盐酸、漂白粉、水玻璃、水银
②化合物:BaCl2、Ca(OH)2、HNO3、HT
③电解质:明矾、冰醋酸、氯化银、纯碱
④同素异形体:金刚石、石墨、C60、C70
A.①② B.②③ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.向碳酸氢钠溶液中滴入氢氧化钠 HCO3-+OH-=CO32-+H2O
B.向碳酸氢钾溶液中滴入过量澄清石灰水 2HCO3-+Ca2++2OH-=CO32-+2H2O+CaCO3↓
C.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++OH-+H++SO42- ==BaSO4↓+H2O
D.硫酸铜和氢氧化钡溶液混合SO42-+Ba2+=+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25 ℃时氯气氯水体系中存在以下平衡关系:
Cl2(g) Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+H2O HClO+H++Cl- K2=10-3.4
HClO+H++Cl- K2=10-3.4
HClO H++ClO- Ka=?
H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中占分数(α)随pH变化的关系如图所示 。下列表述正确的是( )

A.Cl2(g)+H2O 2H++ClO-+Cl- K=10-10.9
2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com