
| A. | Fe与S混合加热生成FeS2 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 白磷在空气中加热到一定温度能转化为红磷 | |
| D. | 过量的铜与稀硝酸反应有一氧化氮生成 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氨气通入稀硫酸中:NH3+H+═NH4+ | |
| B. | 小苏打溶液和烧碱溶液反应:HCO3-+2OH-═CO32-+H2O | |
| C. | 一小块金属钠投入水中:Na+2H2O═Na++OH-+H2↑ | |
| D. | 澄清石灰水中加入过量硝酸:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
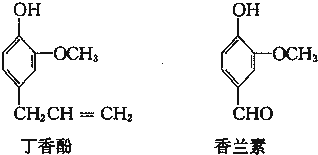
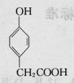 、
、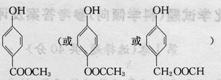 .
.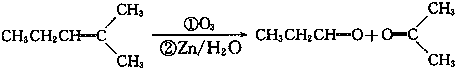
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
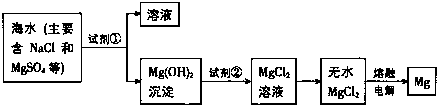
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
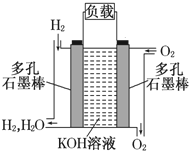 如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题:
如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中相对分子质量大的熔、沸点一定比相对分子质量小的高 | |
| B. | 在氯化钠晶体中,每个氯离子周围都紧邻12个氯离子 | |
| C. | 在金属铜的晶体中,由于存在自由电子,因此铜能导电 | |
| D. | 金刚石的网状结构中,最小的环上有6个碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
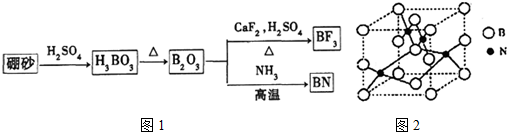

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com