
中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。下列推断不正确的是( )
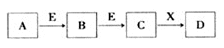
A.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B.若D是一种强碱,则A、B、C均可与X反应生成D
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或 C
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源:2016-2017学年陕西省高二上期中化学卷(解析版) 题型:选择题
下列各组有机化合物中,肯定属于同系物的是( )
A.C3H6与C5H10 B.C4H6与C5H8 C.C3H8与C5H12 D.C2H2与C6H6
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第三次质检化学试卷(解析版) 题型:选择题
在日常生活中,下列解决问题的方法不可行的是
A.为加快漂白精的漂白速率,使用时可滴加几滴醋酸
B.为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中
C.为减少“白色污染”,应严格执行“禁塑令”
D.为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土
查看答案和解析>>
科目:高中化学 来源:2017届山东省日照市高三上学期期中化学试卷(解析版) 题型:选择题
下列措施中,可以改变反应活化能的是( )
A.增大反应物浓度 B.使用催化剂 C.升高温度 D.增大压强
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期第三次月考化学试卷(解析版) 题型:实验题
有一透明溶液,已知其中可能含有的离子为:Mg2+、Cu2+、Fe2+、Al3+、NH4+、K+、Cl-、HCO3-、SO42-。当加入一种淡黄色粉末状固体物质时,有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4mol淡黄色粉末时,共收集到0.3mol混合气体,且此时生成的沉淀最多。此后继续加入淡黄色粉末时,沉淀量逐渐减少,至加入0.45mol粉末后,沉淀量由0.3mol减少至0.2mol,再加入粉末后,沉淀就不再减少。由此实验现象及数据判断:
(1)淡黄色粉末的名称为 ;
(2)溶液中肯定有 离子,肯定没有 离子,可能有__________离子;
(3)写出下列反应方程式:
①淡黄粉末与水反应 ;
②产生刺激性气味气体的离子方程式 ;
③加入淡黄色粉末的物质的量由0.4mol至0.45mol时,沉淀部分消失,反应的离子方程式为 ;
(4)溶液中阳离子的物质量之比为 (H+及没有确定的离子除外)
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第三次周考化学卷(解析版) 题型:推断题
Ⅰ.已知A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,J是一种黑色固体,I的浓溶液具有还原性,A~I均为中学化学常见物质,它们之间的转化关系如图所示.(部分生成物和反应条件已略去)
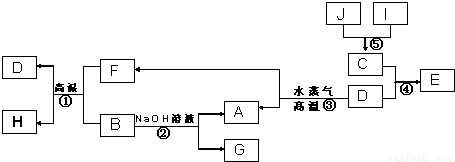
请回答下列问题:
(1)写出组成物质D的元素在周期表中的位置:_________________。
(2)写出反应②的化学方程式:___________________。
(3) J在H2O2分解反应中作催化剂.若将适量J加入酸化的H2O2溶液中,J溶解生成它的+2价离子,该反应的离子方程式是___________________。
Ⅱ.某无色溶液,其中可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下:
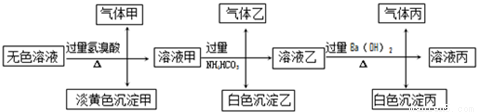
回答下列问题:
(4)生成沉淀甲的离子方程式:__________________;
(5)已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
步骤 | 实验目的 | 试剂 | 现象 |
1 | |||
2 | |||
3 | |||
4 |
(6)针对溶液中可能存在的离子,用实验验证其是否存在的方法是_______________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第三次周考化学卷(解析版) 题型:选择题
A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系,(部分反应物质已略去)。A为一种金属单质,反应①②③均为化合反应,反应④为置换反应。下列有关说法正确的是
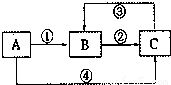
A.①中所加试剂只能是Cl2
B.③中需要加具有还原性的试剂
C.A与稀硝酸反应一定能实现元素M 在①中发生的价态变化
D.元素M在②中发生的价态变化也能通过加KI溶液实现
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上模拟四化学卷(解析版) 题型:实验题
硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质。用硼泥生产氢氧化镁的工艺流程如下图所示:
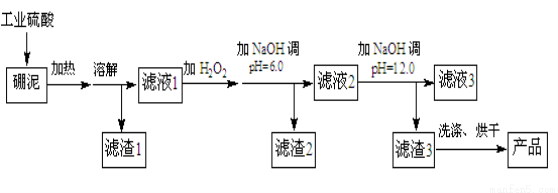
已知某些氢氧化物沉淀的pH如下表所示:
氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
Mg(OH)2 | 9.3 | 10.8 |
Fe(OH)2 | 7.6 | 9.6 |
Al(OH)3 | 4.1 | 5.4 |
Fe(OH)3 | 2.7 | 3.7 |
(1)MgO的电子式为 ,加入H2O2的目的是______________。
(2)滤渣2的主要成分是 ,向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为 。
(3)加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为 。
(4)利用Mg(OH)2与含SO2的烟气反应生成MgSO4,可以使烟气脱硫,该反应的化学方程式为 。
(5)若取a吨硼泥为原料,最后得到b吨Mg(OH)2产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为 (用含有a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上12月月考化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的的是
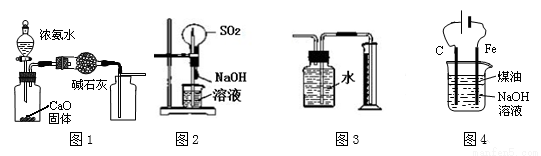
A.用图1装置制取并收集干燥纯净的NH3
B.用图2装置可以完成“喷泉”实验
C.用图3装置直接测量Cu与浓硝酸反应产生的NO2体积
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com