
| A、①④⑥ | B、①②③ |
| C、④⑤⑥ | D、①④⑤⑥ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
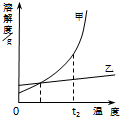
| A、t1℃时,物质的量浓度:甲=乙 |
| B、温度变化相同时,溶解度数值的变化量:甲>乙 |
| C、t2℃时,饱和溶液中溶质的质量分数:甲=乙 |
| D、相同质量的饱和溶液由t2℃降到t1℃时,析出的固体:甲<乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、①⑤⑥ |
| C、②③⑤ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水能导电,所以氨气是电解质 |
| B、SO2的水溶液能导电,但是SO2是非电解质 |
| C、水溶液中NaHSO4=Na++HSO4- |
| D、FeCl3溶液为酸性,因为Fe3++3H2O=Fe(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
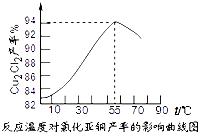 氯化亚铜(Cu2Cl2)是一种重要的化工产品,常用作有机合成催化剂.已知:
氯化亚铜(Cu2Cl2)是一种重要的化工产品,常用作有机合成催化剂.已知: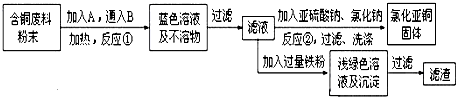
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com