
【题目】下列实验操作、实验现象和实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向一定浓度CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S酸性比H2SO4强 |
B | 常温下,相同铝片分别投入足量稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越大 |
C | 2mL0.1mol·L-1MgCl2溶液中滴加2滴1mol·L-1NaOH溶液,再滴加2滴0.1mol·L-1FeCl3溶液 | 先生成白色沉淀,后生成红褐色沉淀 | Ksp[Mg(OH)2]>|Ksp[Fe(OH)3] |
D | 向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,振荡后加入几滴有机物Ⅹ溶液,加热 | 未出现砖红色沉淀 | Ⅹ不可能是葡萄糖 |
A. A B. B C. C D. D
【答案】C
【解析】A,向CuSO4溶液中通入H2S,发生反应的化学方程式为:CuSO4+H2S=CuS↓+H2SO4,H2S为弱酸,H2SO4为强酸,该反应发生的原因是:CuS不仅难溶于水而且难溶于酸,生成难溶的CuS使得离子浓度减小,A项错误;B,常温下铝与浓硫酸发生钝化,铝片在浓硫酸中不能溶解,B项错误;C,2mL0.1mol/LMgCl2溶液中滴加2滴1mol/LNaOH溶液,产生白色Mg(OH)2沉淀后MgCl2过量,再滴加2滴0.1mol/LFeCl3溶液,白色沉淀转化为红褐色Fe(OH)3沉淀,根据沉淀转化的一般原则,Ksp[Mg(OH)2]![]() Ksp[Fe(OH)3],C项正确;D,向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,产生Cu(OH)2悬浊液且CuSO4溶液过量,加入X溶液,加热未出现砖红色沉淀,不能说明X中不含醛基,X可能是葡萄糖,D项错误;答案选C。
Ksp[Fe(OH)3],C项正确;D,向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,产生Cu(OH)2悬浊液且CuSO4溶液过量,加入X溶液,加热未出现砖红色沉淀,不能说明X中不含醛基,X可能是葡萄糖,D项错误;答案选C。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】偏钒酸镁在化工“新型材料”光电领域有着重要的用途。以硼泥[主要成分是MgO(52.1%),还有Fe2O3、FeO、Al2O3、SiO2等杂质]为原料设计制备偏钒酸镁的生产工艺如图所示:
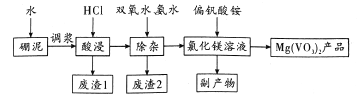
回答下列问题:
(l)Mg(VO3)2 中V的化合价为_____,副产物的电子式为_______。
(2)酸浸时,反应温度需控制在80℃,在实验室可采取的措施为______。写出”酸浸”后溶液中存在的金属阳离子_______,废渣1可用于制作_______,该物质在信息传输中具有重要应用。
(3)“除杂”过程加人双氧水的目的是_______(用离子方程式表示)。此过程中使Fe3+、Al3+浓度均小于l×10-6mol·L-1,在室温下需调节pH范围为__________[已知Ksp[Fe(OH)3]= 1×10-39, Ksp[Al(OH)]=1×10-33, pH=9.3时,Mg2+开始沉淀]。
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作:__________。
(5)偏钒酸氨可由VOSO4溶液中加入氯酸钾将其氧化,然后用氨水调节pH即可制得,写出VO2+被氯酸钾氧化的离子方程式_________。
(6)现用a t硼泥生产Mg(VO3)2,若生产过程的产率为6%,则能生产出Mg(VO3)2产品的
质量为_________t (用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知723 K时,2SO2(g)+O2(g)![]() 2SO3(g)ΔH=﹣QkJ·
2SO3(g)ΔH=﹣QkJ·![]() ,在相同条件下,向一密闭容器中通入2mol SO2和1 mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ.则Q1、Q2、Q满足的关系是( )
,在相同条件下,向一密闭容器中通入2mol SO2和1 mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2kJ.则Q1、Q2、Q满足的关系是( )
A. Q2=![]() B. Q2>
B. Q2>![]() C. Q2<Q1<Q D. Q=Q1>Q2
C. Q2<Q1<Q D. Q=Q1>Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新泽茉莉醛是一种名贵的香料.其合成路线如下:
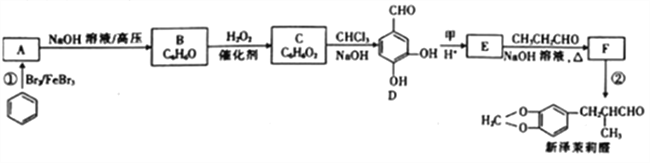
已知:①RCHO+R'CH2CHO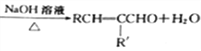
②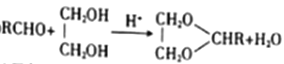
(1)已知甲的相对分子质量为30,甲的结构简式为____。E中含氧官能团的名称是____。
(2)反应②的反应类型是____ 。
(3)写出反应①的化学方程式:_________________。
(4)芳香族化合物G与E互为同分异构体,1molG能与足量NaHCO3溶液反应产生1mol气体,且G能发生银镜反应。则G的结构有______种。其中一种结构苯环上的一氯代物有两种,且被氧化后能与C反应生成高分子化合物,写出该高分子化合物的结构简式:_______。
(5)结合已知①,设计以乙醇和苯甲醛![]() 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备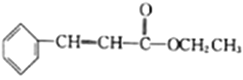 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)


(1)写出①~④的仪器名称:①__________,②__________,③________,④________。
(2)实验室制取并收集氧气时应选择________和________相连接,制取并收集氢气时应选择________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验,应选择________和________相连接,检验气体时观察到的实验现象是__________________________________________________。
(4)制取氢气并做还原氧化铜的实验,应选择________和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:
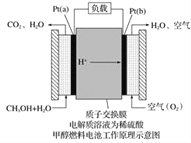
请回答下列问题:
(1)Pt(a)电极是电池的________极,电极反应式为__________________;Pt(b)电极发生________(填“氧化”或“还原”)反应,电极反应式为___________。
(2)电池的总反应方程式为____________________。
(3)如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮(N)、磷(P)、砷(As)等VA族元素化合物在研究和生产中有重要用途。如我国科研人员研究发现As2O3(或写成As4O6,俗称砒霜)对白血病有明显的治疗作用回答下列问题:
(1)As原子的核外电子排布式为_________________;P的第一电离能比S大的原因为_______________
(2)写出一种与CNˉ互为等电子体的粒子________(用化学式表示);(SCN)2分子中σ键和π键个数比为___________
(3)砒霜剧毒,可用石灰消毒生成AsO33-和少量AsO43-,其中AsO33-中As的杂化方式为__________,AsO43-的空间构型为___________
(4)NH4+中H一N一H的键角比NH3中H 一N一H的键角大的原因是__________;NH3和水分子与铜离子形成的化合物中阳离子呈轴向狭长的八面体结构(如下图I),该化合物加热时首先失去水,请从原子结构角度加以分析:__________
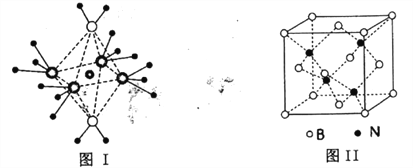
(5)BN的熔点为3000℃,密度为2.25g·cm-3,其晶胞结构如上图Ⅱ所示,晶体中一个B原子周围距离最近的N原子有__________个;若原子半径分别为rNpm和rBpm,阿伏加德罗常数值为NA,则BN晶胞中原子的体积占晶胞体积的百分率为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法中,正确的是( )
A. 1 mol Cl2作为氧化剂得到的电子数为NA
B. 在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C. 25 ℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
D. 将0.1 mol FeCl3加到沸水中制得的胶体中,含胶粒0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com