
 钒及其化合物非常丰富.钒可用于生产合金钢、航天用的钒钛合金及化工催化剂等.
钒及其化合物非常丰富.钒可用于生产合金钢、航天用的钒钛合金及化工催化剂等.分析 (1)V的核电荷数为23,其基态核外电子排布式为[Ar]3d34s2或1s22s22p63s23p63d34s2;
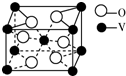
(2)用均摊法晶胞中钒8×$\frac{1}{8}$+1=2,而氧的原子个数为4×$\frac{1}{2}$+2=4;
(3)与NH3互为等电子体的一种阳离子为水合氢离子;
(4)常温下V(CO)6为蓝绿色固体,易挥发,易升华,不溶于水,溶于乙醚、吡啶(N).
①易挥发,易升华,固态V(CO)6属于分子晶体;
②吡啶(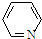 ),分子中N原子的杂化类型为sp2;
),分子中N原子的杂化类型为sp2;
③V(CO)6中含有的化学键有σ键、π键、配位键.
解答 解:(1)V的核电荷数为23,其基态核外电子排布式为[Ar]3d34s2或1s22s22p63s23p63d34s2,故答案为:[Ar]3d34s2或1s22s22p63s23p63d34s2;
(2)用均摊法晶胞中钒8×$\frac{1}{8}$+1=2,而氧的原子个数为4×$\frac{1}{2}$+2=4,所以则该氧化物的化学式为VO2,故答案为:VO2;
(3)与NH3互为等电子体的一种阳离子为水合氢离子,故答案为:H3O+;
(4)①易挥发,易升华,固态V(CO)6属于分子晶体;
②吡啶(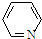 ),分子中N原子的杂化类型为sp2;
),分子中N原子的杂化类型为sp2;
③V(CO)6中含有的化学键有σ键、π键、配位键,故答案为:①分子;②sp2;③ABC.
点评 本题考查较为综合,涉及电子排布、化学键、杂化、晶体类型等多个方面的知识,注意电子排布式的书写方法,侧重物质结构与性质的考查,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 环境污染 |  白色污染 |  雾霾 |  臭氧空洞 |  酸雨 |
| 产生原因 | 聚乙烯等塑料 | 胶体的丁达尔效应 | 氟利昂的泄漏 | 煤的直接燃烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
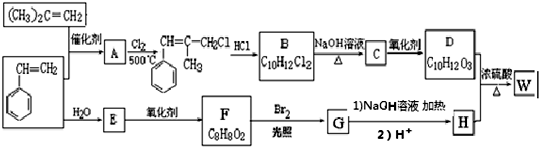
 .
.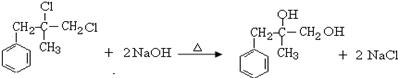 ;由D生成高分子化合物的方程式为
;由D生成高分子化合物的方程式为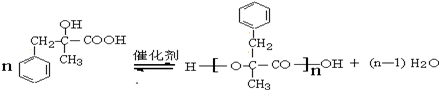 .
.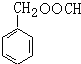 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为吸热反应 | |
| B. | 该反应中,SO2为还原剂 | |
| C. | 1 mol H2S中含有的共价键的数目为3 mol | |
| D. | 常温下,H2S的还原性强于S的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若电解熔融MgCl2产生1 mol Mg,理论上转移的电子数约为2×6.02×1023 | |
| B. | 海轮船体镶嵌锌块是牺牲阳极的阴极保护法,防止船体被腐蚀 | |
| C. | 室温下,pH均为3的盐酸和NH4Cl溶液中,水的电离程度相同 | |
| D. | 一定条件下反应2SO2+O2?2SO3达到平衡时,v正(O2)=2v逆(SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
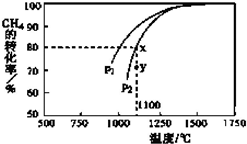 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | E(反应物)>E(生成物) | B. | E(反应物)<E(生成物) | C. | 反应放热 | D. | 反应吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③④ | C. | ②③ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com