
| A. | Na2O2只作氧化剂,O2是还原产物 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 由上述方程式可知氧化性:Na2FeO4>Na2O2>O2 | |
| D. | 2 mol FeSO4发生反应时,反应中共有8 mol电子转移 |
分析 该反应中Fe元素化合价由+2价变为+6价、O元素化合价由-1价变为0价、-2价,所以硫酸亚铁是还原剂、过氧化钠既是氧化剂又是还原剂,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物,以此解答该题.
解答 解:A.O元素化合价由-1价变为0价、-2价,Na2O2既是氧化剂也是还原剂,O2是氧化产物,故A错误;
B.该反应中Fe元素化合价由+3价变为+6价、O元素化合价由-1价变为0价、-2价,所以硫酸亚铁是还原剂、过氧化钠既是氧化剂又是还原剂,Na2FeO4既是氧化产物又是还原产物,故B正确;
C.由氧化剂的氧化性大于氧化产物的氧化性可知,氧化性Na2O2>Na2FeO4,故C错误;
D.反应中化合价升高的元素有Fe,由+2价→+6价,化合价升高的元素还有O元素,由-1价→0价,2molFeSO4发生反应时,共有2mol×4+1mol×2=10mol电子转移,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、基本概念为解答的关键,侧重分析与应用能力的考查,注意过氧化钠的作用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 离子半径 | 得电子能力 | 酸性 | 金属性 |
| Cl->Al3+ | 16O=18O | H2CO3>H2SiO3 | Cu<Al |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰和石英晶体中的化学键类型相同,熔化时需克服微粒间的作用力类型也相同 | |
| B. | 化学变化发生时,需要断开反应物中的化学键,并形成生成物中的化学键 | |
| C. | CH4和CCl4中,每个原子的最外层都具有8电子稳定结构 | |
| D. | NaHSO4晶体溶于水时,离子键被破坏,共价键不受影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 让Cl2和H2混合后,点燃生成氯化氢气体,再将氯化氢气体通入水中获得盐酸 | |
| B. | 制备硫酸,用水吸收三氧化硫气体生成浓硫酸 | |
| C. | 侯氏制碱法,将二氧化碳通入含氨的氯化钠饱和溶液中,过滤得到碳酸氢钠晶体 | |
| D. | 用电解熔融氯化铝和冰晶石的混合物的方法得到铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
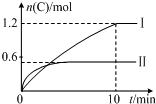 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=akJ•mol-1实验内容和结果分别如表和如图所示.下列说法正确的是( )| 实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1mol | 3mol | 96kJ |
| Ⅱ | 800℃ | 1.5mol | 0.5mol | ─ |
| A. | a=-160 | |
| B. | 600℃时,该反应的平衡常数是0.45 | |
| C. | 实验Ⅰ中,10min内平均速率v(B)=0.06mol•L-1•min-1 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5molA和1.5molB,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2CO3和1mol NaOH | B. | 1mol Na2CO3和2mol NaOH | ||
| C. | 2mol Na2CO3和2mol NaOH | D. | 2mol Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “物质的量”是国际单位制对一个基本单位 | |
| B. | 1mol任何物质均含有6.02×1023个分子 | |
| C. | 物质对摩尔质量等于其其相对分子质量或相对原子质量 | |
| D. | 0.012kg12C中所含对碳原子数为NA(NA代表阿伏加德罗常数对数值) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com