
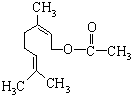
乙酸橙花酯是一种食用香料,结构如图所示。下列关于该有机物的说法有如下几种:
①该有机物有一种同分异构体属于酚类;
②该有机物属于酯类;
③该有机物不能发生银镜反应;
④该有机物的分子式为C11H18O2;
⑤1mol该有机物最多能与1mol NaOH反应。其中正确的是
A.①③④ B.②③⑤ C.①④⑤ D.①③⑤
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
某课外活动小组设计了如图所示装置,调节滑动变阻器,在电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b)。由于粗心,实验并未达到预期目的,但也看到了令人高兴的现象。请帮助他们分析并回答下列问题(图中阳离子交换膜只允许阳离子和水分子通过):
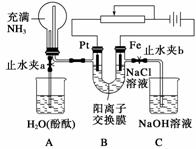
(1)写出B装置中的电极反应式:
Pt极____________________________________________________________________;
Fe极____________________________________________________________________。
(2)写出观察到的A装置中的现象:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(3)当观察到A装置中的现象后,他们关闭止水夹a,打开止水夹b,再观察C装置。若无现象,说明理由;若有现象,请写出有关反应方程式__________________________
________________________________________________________________________。
(4)若想达到电解NaCl溶液的目的,应如何改进装置,请提出你的意见________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。
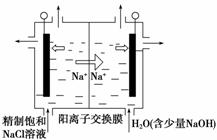
①图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为_____________________________________________________________
________________________________________________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________ mol;用平衡移动原理解释阴极区pH增大的原因:_____________________________________________________________________
________________________________________________________________________。
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为_________________________________________________
________________________________________________________________________。
若以该电池为电源,用石墨作电极电解100 mL含有如下离子的溶液。
| 离子 | Cu2+ | H+ | Cl- | SO |
| c/mol·L-1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为________ mol。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将 Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用右 图装置模拟上述过程:
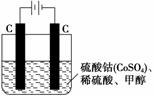
①写出阳极电极反应式:_________________________________________________。
②除去甲醇的离子反应为6Co3++CH3OH+H2O===CO2↑+6Co2++6H+,该过程中被氧化的元素是__________,当产生标准状况下2.24 L CO2时,共转移电子________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生做乙醛还原性的实验,取l mol/L的硫酸铜溶液2 mL和0.4mol/L的氢氧化钠溶液 4 mL,在一支试管里混合后加入0.5 mL 40%的乙醛溶液加热至沸腾,无红色沉淀,实验失败的原因是( )
A.氧氧化钠的量不够 B.硫酸铜不够量 C.乙醛溶液太少 D.加热时间不够
查看答案和解析>>
科目:高中化学 来源: 题型:
由碳、氢、氧3种元素组成的有机物A,相对分子质量为152,其分子中C、H原子个数比为1∶1,氧元素的质量分数为31.58%。A遇FeCl3溶液显紫色,A能与NaHCO3溶液反应,其苯环上的一氯取代物有两种,请回答下列问题:(10分)
(1)A的分子式是____________________________________;(2分)
(2)A的结构简式为___________________________________;(2分)
(3)A可以发生如图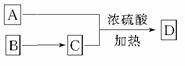 所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式__________________________________。
所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式__________________________________。
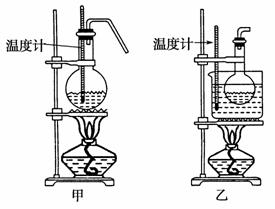
(4)甲、乙两装置均可用作实验室由C制取B的装置,乙图采用甘油浴加热 (甘油沸点290 ℃,熔点18.17℃),当甘油温度达到反应温度时,将盛有C和浓硫酸混合液的烧瓶放入甘油中,很快达到反应温度。甲、乙两装置相比较,乙装置有哪些优点________。(4分)
查看答案和解析>>
科目:高中化学 来源: 题型:
可用来鉴别己烯、甲苯、乙酸乙酯和苯酚溶液的一组试剂是
A. 溴水、氯化铁溶液 B. 溴水、酸性高锰酸钾溶液
C. 溴水、碳酸钠溶液 D. 氯化铁溶液、酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是
A. 只有醛类物质才能发生银镜反应
B. 甲醛、乙醛、丙醛都没有同分异构体
C. 将2%的稀氨水逐滴加入2%的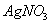 溶液中,至沉淀恰好溶解为止,可制得银氨溶液
溶液中,至沉淀恰好溶解为止,可制得银氨溶液
D. 将2%的NaOH溶液4~6滴,滴入2mL10%的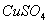 溶液中制得
溶液中制得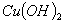 悬浊液,用作检验醛基的试剂
悬浊液,用作检验醛基的试剂
查看答案和解析>>
科目:高中化学 来源: 题型:
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s)2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO42-(aq)+2H2O
为 能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程
能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程 如下:
如下:
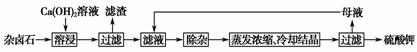
(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:________________________________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液pH至中性。
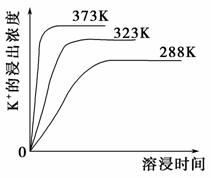 (4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,①_________,
(4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,①_________,
②________________________________________
________________________________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32-CaCO3(s)+SO42-
已知298 K时,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4 )=4.90×10-5,求此温度下该反应的平衡常数K
)=4.90×10-5,求此温度下该反应的平衡常数K (计算结果保留三位有效数字)。
(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在C(s)+CO2(g)===2CO(g)的反应中,现采取下列措施:
①缩小体积,增大压强 ②增加碳的量 ③通入CO2 ④恒容下充入N2
⑤恒压下充入N2能够使反应速率增大的措施是( )
A.①④ B.②③⑤ C.①③ D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com