
| A. | ①③⑤ | B. | ②③⑤ | C. | ①②④ | D. | ②④⑤ |
分析 “节能减排、保护环境”的主题是节约能源,减少二氧化碳等温室气体的排放,有计划的发展,科学的发展,据此解答.
解答 解:①加快化石燃料的开采与使用会增加污染物的排放量,不利于保护环境,故不选;
②实施清洁生产有利于减少污染物的排放,减小环境污染,故选;
③应用高效洁净的能源转换技术,可以节约能源,减少二氧化碳的排放,有利于保护环境,节能减排,故选;
④田间焚烧秸秆增加二氧化碳的排放,增加环境污染,不利于保护环境,故不选;
⑤推广使用节能环保材料可以节约能源,减少二氧化碳的排放,有利于保护环境,节能减排,故选;
故选:B.
点评 本题考查了环境的污染与防护,明确绿色化学、绿色生活的含义是解题关键,题目难度不大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 各种物质都储存有化学能 | |
| B. | 化学反应一定伴随着能量的变化 | |
| C. | 断开反应物中的化学键要释放出能量 | |
| D. | 化学反应中的能量变化,通常主要表现为热量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
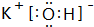 .
.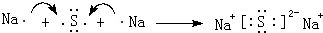 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol-CH3含有的电子数为10NA | |
| B. | 92gNO2气体中含有原子数为6NA | |
| C. | 1molC2H4分子中含共价单键总数为8NA | |
| D. | 标准状况下22.4LCHCl3中含有原子总数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
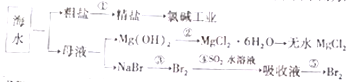 海洋中含有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法中错误的是( )
海洋中含有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程.下列有关说法中错误的是( )| A. | 大量的氮、磷废水排入海洋,易引起赤潮 | |
| B. | 空气吹出法是用于工业规模海水提溴的常用方法 | |
| C. | 在过程③中溴元素被氧化,而在过程④中溴元素被还原 | |
| D. | 过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+、等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
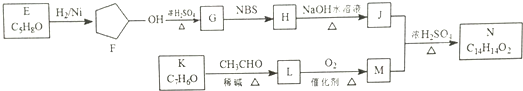
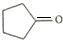 .
. .
.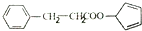 ,请再写出三种五元环上不是含一个双键的同分异构体:
,请再写出三种五元环上不是含一个双键的同分异构体: 、
、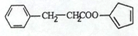 、
、 .
.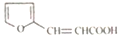 )是一种医治血吸虫病的药呋喃丙胺的原料.请以
)是一种医治血吸虫病的药呋喃丙胺的原料.请以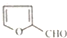 、CH3CH2OH为有机原料合成呋喃.(无机试剂及溶剂任选)
、CH3CH2OH为有机原料合成呋喃.(无机试剂及溶剂任选)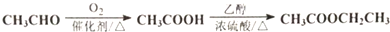
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 碘是人体所必需的因素之一回答以下有关碘的问题:
碘是人体所必需的因素之一回答以下有关碘的问题:| KI起始浓度/mol•L-1 | 0.02 | 0.04 | 0.06 | 0.08 | 0.10 |
| I3-% | 88.98 | 88.04 | 85.28 | 82.26 | 79.23 |
| I42-% | 4.38 | 8.67 | 12.60 | 16.21 | 19.53 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com