
能用来区别NH4Cl、NaCl、Na2CO3三种物质的试剂(必要时可以加热)是
A、AgNO3溶液 B、稀硫酸 C、稀盐酸 D、Ba(OH)2溶液
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源:2015届广东省肇庆市高三一模理综化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.往CaCl2溶液中通入少量的CO2: Ca2++CO2+H2O==CaCO3↓+2H+
B.向碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3- + OH-==CO32-+ H2O
C.向AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O=A1O2-+4NH4++2H2O
D.向Ba(OH)2溶液中加入少量的NaHSO3溶液:HSO3-+Ba2++OH-==BaSO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高一第一学期期中考试化学试卷(解析版) 题型:选择题
海带中含碘元素,从海带中提取碘有如下步骤:
①通入足量Cl2 ②将海带焙烧成灰后加水搅拌 ③加CCl4振荡
④用分液漏斗分液 ⑤过滤
合理的操作顺序是
A.②⑤①③④ B.①②③④⑤ C.②①③⑤④ D.①③⑤②④
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A、16g O2中含有的氧分子数为NA
B、1mol Zn变为Zn2+时失去的电子数目为NA
C、常温常压下,11.2 L H2中含有的氢分子数为0.5NA
D、1L 1 mol·L-1 BaCl2溶液中含有的钡离子数为NA
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:选择题
同温、同压下,决定气体体积的主要因素是
A、气体分子的直径 B、气体的分子数目
C、气体分子间的平均距离 D、气体分子的摩尔质量
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:选择题
下列仪器中,不能用来加热的是
A、容量瓶 B、蒸发皿 C、蒸馏烧瓶 D、试管
查看答案和解析>>
科目:高中化学 来源:2015届江苏省淮安市高三上学期第一次阶段性测试化学试卷(解析版) 题型:选择题
温度为T时,向2.0 L恒容密闭容器中充入2.0 mol NO2,反应2NO2(g) N2O4(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O4(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(N2O4)/mol | 0 | 0.12 | 0.18 | 0.20 | 0.20 |
下列说法正确的是
A.反应在前50 s的平均速率为v(NO2)=0.001 2 mol·L-1·s-1
B.保持温度不变,向平衡后的容器中充入1.0 mol N2O4时,v(正)<v(逆)
C.保持其他条件不变,升高温度达到新平衡时K=0.125,则反应的ΔH<0
D.T温度时,若起始向容器中充入2.0 mol N2O4,则平衡时N2O4的转化率大于80%
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:实验题
(16分)硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.【查阅资料】
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3;所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
II.【制备产品】
实验装置如图所示(省略夹持装置):
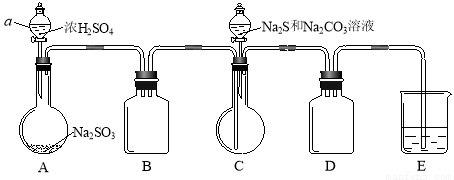
实验步骤:
(1)检查装置气密性,按图示加入试剂。
仪器a的名称是 ;E中的试剂是 (选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加H2SO4。
(3)等Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液 (填写操作名称)、结晶、过滤、洗涤、干燥,得到产品。
III.【探究与反思】
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,
,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是
。
(3)Na2S2O3·5H2O的溶液度随温度升高显著增大,所得产品通过 方法提纯。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水
所选试剂为 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:实验题
(12分)钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。下图是化工生产中制备金属钼的实验流程图:
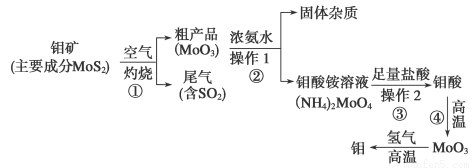
(1)钼酸铵溶液中阳离子的检验方法:________________________________________。
(2)写出反应①的化学方程式:______________________________________________。
(3)反应①的尾气可以用NH3·H2O溶液吸收用于合成肥料,写出反应的离子方程式
______________________________________________________________________。
(4)工厂排放的废水中,金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。处理时首先在酸性条件下用H2O2将Cr3+转化为Cr2O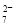 ,再用NaOH调节溶液的pH到8,然后用钠离子交换树脂除去Ca2+和Mg2+,最后通入SO2 生成CrOH(H2O)5SO4沉淀。
,再用NaOH调节溶液的pH到8,然后用钠离子交换树脂除去Ca2+和Mg2+,最后通入SO2 生成CrOH(H2O)5SO4沉淀。
①H2O2的作用是将溶液中的Cr3+转化为Cr2O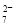 ,写出此反应的离子方程式:______________。
,写出此反应的离子方程式:______________。
②常温下,部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
完全沉淀时的pH | 3.7 | 11.1 | 8(>9溶解) | 9 |
加入NaOH溶液使溶液呈碱性,Cr2O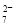 转化为CrO
转化为CrO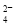 。但溶液的pH不能超过8,此时产生的沉淀是:____________________________________。
。但溶液的pH不能超过8,此时产生的沉淀是:____________________________________。
③写出上述过程中用SO2作还原剂进行还原的离子方程式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com