
 短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一.
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是形成酸雨的主要物质之一.| X | |||
| Z | W | Y |
 .
.分析 其中W的氧化物是形成酸雨的主要物质之一,则W为S,结合短周期元素X、Y、Z、W在周期表中的位置图可知,X是C元素,Z是Si元素,Y是Cl元素.
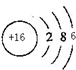
(1)S的原子核内有16个质子,核外有16个电子;
(2)根据盖斯定律,③-2×②-①可得所求热化学方程式,所以△H=-802.0 kJ•mol-1-2×(-242.0 kJ•mol-1)-(-393.5 kJ•mol-1)=+75.5kJ/mol,以此书写热化学方程式;
(3)SiO中Si为+2价,与氢氧化钠溶液反应生成一种固体和一种钠盐,则该固体只能是Si,说明Si元素的化合价降低,同时升高到+4价,所以产物中有硅酸钠,根据元素守恒,产物中有水生成;
(4)化合物甲的组成中钙、元素Y的质量分数分别为52.29%、46.41%,则Ca、Cl的原子个数比是52.29/40:46.41/35.5=1:1,根据化合价代数和为0的原则,说明甲中还含有H元素,所以甲的化学式是CaHCl;化合物乙的水溶液显酸性,则乙只能是HCl;甲与水反应生成氢气,根据元素守恒,产物中还有氢氧化钙、氯化钙;(5)①根据图象,加入盐酸后未立即产生气体,说明溶液中存在氢氧化钠,盐酸先与氢氧化钠反应生成氯化钠和水,所以硫化氢与过量的氢氧化钠溶液反应,生成硫化钠和水,同时溶液中存在氢氧化钠;
②a点加入3mol氢氧化钠时开始产生硫化氢气体,此时3molHCl与氧化钠反应生成3mol氯化钠和水,所以溶液中的氯离子的物质的量是3mol,加入5mol氢氧化钠时气体物质的量不再增加,此时溶液为氯化钠溶液,说明钠离子的物质的量是5mol.
解答 解:W的氧化物是形成酸雨的主要物质之一,二氧化硫是形成酸雨的成分之一,所以W是S元素;则X是C元素,Z是Si元素,Y是Cl元素.
(1)S的原子核内有16个质子,核外有16个电子,所以原子结构示意图为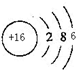 ,故答案为:
,故答案为: ;
;
(2)根据盖斯定律,③-2×②-①可得所求热化学方程式,所以△H=-802.0 kJ•mol-1-2×(-242.0 kJ•mol-1)-(-393.5 kJ•mol-1)=+75.5kJ/mol,所以所求热化学方程式为CH4(g)=2H2(g)+C(s)△H=+75.5kJ/mol,故答案为:CH4(g)=2H2(g)+C(s)△H=+75.5kJ/mol;
(3)SiO中Si为+2价,与氢氧化钠溶液反应生成一种固体和一种钠盐,则该固体只能是Si,说明Si元素的化合价降低,同时升高到+4价,所以产物中有硅酸钠,根据元素守恒,产物中有水生成,所以化学方程式为2SiO+2NaOH=Si+Na2SiO3+H2O,故答案为:2SiO+2NaOH=Si+Na2SiO3+H2O;
(4)化合物甲的组成中钙、元素Y的质量分数分别为52.29%、46.41%,则Ca、Cl的原子个数比是52.29/40:46.41/35.5=1:1,根据化合价代数和为0的原则,说明甲中还含有H元素,所以甲的化学式是CaHCl;化合物乙的水溶液显酸性,则乙只能是HCl;甲与水反应生成氢气,根据元素守恒,产物中还有氢氧化钙、氯化钙,所以化学方程式为2CaHCl+2H2O=CaCl2+Ca(OH)2+2H2↑,
故答案为:HCl;2CaHCl+2H2O=CaCl2+Ca(OH)2+2H2↑;
(5)①根据图象,加入盐酸后未立即产生气体,说明溶液中存在氢氧化钠,盐酸先与氢氧化钠反应生成氯化钠和水,所以硫化氢与过量的氢氧化钠溶液反应,生成硫化钠和水,同时溶液中存在氢氧化钠,所以O点的溶质是NaOH、Na2S,故答案为:NaOH、Na2S;
②a点加入3mol氢氧化钠时开始产生硫化氢气体,此时3molHCl与氧化钠反应生成3mol氯化钠和水,所以溶液中的氯离子的物质的量是3mol,加入5mol氢氧化钠时气体物质的量不再增加,此时溶液为氯化钠溶液,说明钠离子的物质的量是5mol,则原溶液中钠离子的物质的量是5mol,所以a点溶液中,c(Na+):c(Cl-)=5:3.
点评 本题考查元素的推断、元素化合物的性质及图象的分析,综合性较强,注重高频考点的考查,把握元素在周期表的位置、元素化合物知识为解答的关键,注意元素周期律的应用及相关反应原理,有利于分析与推断能力的培养,题目难度不大.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | 还原性Na>Mg>Al | B. | 氧化性Cl2>S>P | ||
| C. | 酸性H2SO4>H3PO4>HClO4 | D. | 稳定性HCl>H2S>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
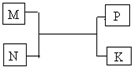 A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红.
A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为共价化合物 | |
| C. | 由Z、M两种元素形成化合物的分子式一定为M2Z | |
| D. | 由 Y、Z、M 三种元素形成的化合物可以既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
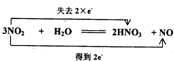
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍的金属性比钠强 | B. | 氯化铍的氧化性比氯化锂弱 | ||
| C. | 氢氧化铍的碱性比氢氧化钙弱 | D. | 单质铍易跟冷水反应生成H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若某温度下,反应后$\frac{c(Cl-)}{c(ClO-)}$=2,则溶液中$\frac{c(C1{O}^{-})}{c(C1{O}_{3}^{-})}$=5 | |
| B. | 参加反应的氯气的物质的量等于$\frac{1}{2}$ a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$ a mol≤ne≤$\frac{5}{6}$ a mol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{1}{7}$a mol |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
确定某溶液中含有SO42-,下列方案中正确的是
A.先加入BaCl2溶液产生白色沉淀,再加入足量稀盐酸沉淀不溶解
B.先加入足量稀盐酸无沉淀,再加入BaCl2溶液产生白色沉淀
C.先加入足量稀硝酸无沉淀,再加入Ba(NO3)2溶液产生白色沉淀
D.先加入Ba(NO3)2溶液无沉淀,再加入足量稀硝酸产生白色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com