
| A. | 金属钠着火时,不能用水来扑灭,可用CO2灭火 | |
| B. | 钠跟CuSO4溶液反应生成的蓝色沉淀上有时会出现暗斑,这是因为析出了金属铜 | |
| C. | 钠在化学反应中常常失去电子被氧化,作氧化剂,故Na+具有强氧化性 | |
| D. | 2.3 g钠与97.7 g水反应后溶液中溶质的质量分数大于4% |
分析 A、水和二氧化碳都与反应产生的过氧化钠反应生成氧气;
B、与水反应放热,氢氧化铜受热分解;
C、失电子的物质是还原剂;
D、根据钠与水反应生成氢氧化钠和氢气的方程式算出反应后溶质氢氧化钠的质量,再算出氢气质量,再计算出溶液质量,根据计算公式再算出所得溶液的质量分数.
解答 解:A、水和二氧化碳都与反应产生的过氧化钠反应生成氧气,所以金属钠着火时,既不能用水来扑灭,也不能用CO2灭火,故A错误;
B、钠跟CuSO4溶液反应生成的蓝色沉淀上有时出现暗斑,钠与水反应放热,氢氧化铜受热分解生成氧化铜,故B错误;
C、在化学反应中常常失去电子被氧化,作还原剂,Na+具有弱氧化性,故C错误;
D、2.3g钠与97.7g水反应,依据2Na+2H2O═2NaOH+H2↑,生成氢氧化钠的质量4g,但是因为反应消耗了水,同时生成氢气,所以溶液的质量小于100g,溶质的质量分数大于4%,故D正确;
故选D.
点评 本题考查了钠的性质,明确钠与盐溶液反应的原理是解题关键,注意钠是活泼金属失电子作还原剂.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 用醋酸除水垢:2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ | |
| C. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| D. | SO2通入碘水中,反应的离子方程式为:SO2+I2+2H2O═SO32-+2I-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极有 O2 逸出 | |
| B. | 铜片上有 H2 逸出 | |
| C. | 电子通过导线由铜片流向锌片 | |
| D. | 正极附近的 SO42- 离子浓度逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
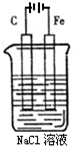 (1)如图是电解NaCl溶液的示意图.请回答下列问题:
(1)如图是电解NaCl溶液的示意图.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有还原性,可用于蔗糖脱色 | |
| B. | 双氧水具有强氧化性,可用于杀菌消毒 | |
| C. | 铁粉表面积大,可用作食品干燥剂 | |
| D. | SiO2具有导电性,可用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
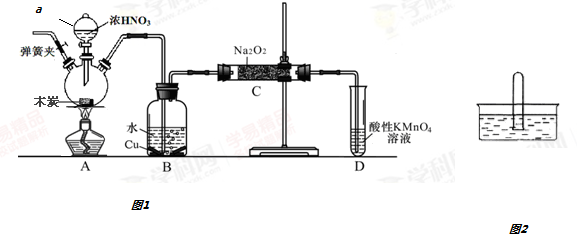
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
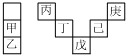 甲~庚等主族元素在周期表中的相对位置如下表,己的最高价氧化物对应的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等主族元素在周期表中的相对位置如下表,己的最高价氧化物对应的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 气态氢化物的稳定性:庚<己<戊 | |
| B. | 庚与戊的原子序数相差24 | |
| C. | 庚与甲形成的单核离子半径大小为:庚<甲 | |
| D. | 丁的最高价氧化物可用于制造计算机的芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g重水(D2O)中含有的质子数和电子数均为NA | |
| B. | 常温下,O2和O3的混合气体共16g中含有的氧原子数为NA | |
| C. | 标准状况下,22.4L NO和22.4L O2混合后所得气体中分子总数为1.5NA | |
| D. | 将11.2LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com