
【题目】具有广泛用途的Na2FeO4可用电解法制取:Fe+2H2O+2OH-![]() FeO42-+3H2↑,其工作原理如图所示。下列叙述正确的是
FeO42-+3H2↑,其工作原理如图所示。下列叙述正确的是

A.电解一段时间后,阳极室的c(OH-)增大
B.Na+由阴极室移向阳极室
C.阴极反应式:2H2O+2e-=H2↑+2OH-
D.电解过程中,当消耗1 mol OH-时,同时生成33.6 L H2
【答案】C
【解析】
试题分析:A.根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,阳极室c(OH-)降低,故A错误;B.电解池中阳离子向阴极移动,因此Na+想阴极室移动,故B错误;C.阴极发生还原反应,反应式为2H2O+2e-=H2↑+2OH-,故C正确;D.根据反应Fe+2H2O+2OH-![]() FeO42-+3H2↑,阴极反应式为6H2O+6e-=3H2↑+6OH-,阳极反应式为Fe+8OH-=FeO42-+4H2O,因此电解过程中,当消耗1 mol OH-时,反应的铁为
FeO42-+3H2↑,阴极反应式为6H2O+6e-=3H2↑+6OH-,阳极反应式为Fe+8OH-=FeO42-+4H2O,因此电解过程中,当消耗1 mol OH-时,反应的铁为![]() mol,同时生成
mol,同时生成![]() mol H2,故D错误;故选C。
mol H2,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】下列各组性质比较,不正确的是( )
A.酸性:HClO4>HBrO4>HIO4
B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S>HCl
D.原子半径:Br>Cl>F
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一种新型的熔融盐燃料电池具有高发电效率而备受重视。现用Li2CO3和Na2CO3的熔融盐混合物做电解质,一极通入CO气体,另一极通入空气和CO2的混合气体,制得燃料电池。该电池工作时的负极反应式为_____________; 熔融盐中CO32-的物质的量在工作时__ (填“增大”、“减少”、“不变”)。
(2)如下图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液见图。关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源a端为_____极,通电一段时间后,观察到滤纸d 端出现的现象是:___________;
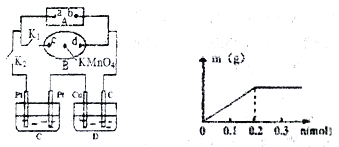
己知C装置中溶液为Cu(NO3)2和X(NO3)2,且均为0.1mol, D装置中的溶液为CuSO4溶液,打开K1,关闭K2,通电一段时间后,C装置阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如右图所示。则Cu2+、X3+氧化能力由大到小的顺序是__ ;D装置C 极的电极反应式为____________。
(3)最近,又有科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2—离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油,①电池的正极反应式为________;②放电时固体电解质里的O2-离子的移动方向是向_______极移动(填正或负)。
(4)某同学利用反应Cu+2H+=Cu2++H2↑设计实验来制取氯化铜溶液。该同学设计的装置应该为______。(填“原电池”或“电解池”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 金属钠与水反应:Na+H2O=Na++OH-+H2↑
B. NaHCO3的水解反应:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
C. 铁和稀HNO3反应后溶液pH=1:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D. 向Mg(HCO3)2溶液中加入过量NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中既能跟稀盐酸反应,又能跟氢氧化钠溶液反应的是( )
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤MgO ⑤Fe(OH) 3 ⑥CuSO4
⑤MgO ⑤Fe(OH) 3 ⑥CuSO4
A. 全部 B. ②③④⑤
C. ①②③④ D. ①②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4溶液与Na2CO3溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
【沉淀制备】
称取12.5 g胆矾溶于87.4 mL蒸馏水中,滴4滴稀硫酸,充分搅拌后得到CuSO4溶液。向其中加入适量Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)滴加稀硫酸的作用是 。所得硫酸铜溶液的溶质质量分数为 。
(2)用无水乙醇洗涤的目的是 。
【实验探究】
同学们设计了如下装置,用制得的蓝绿色固体进行实验:
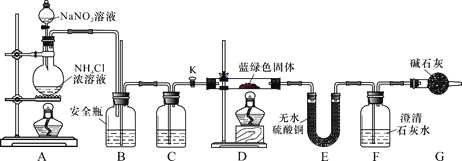
(3)D装置加热前,需要首先打开活塞K,用A装置制取适量N2,然后关闭K,点燃D处酒精灯。A中产生N2的作用是 ,C中盛装的试剂应是 。
(4)装置A中发生反应的离子方程式为 。
(5)若蓝绿色固体的组成为xCuCO3·yCu(OH)2,实验能观察到的现象是 。
(6)同学们查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是 。
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是 。若定量分析所取蓝绿色固体质量为27.1 g,装置F中使用Ba(OH)2溶液,实验结束后,装置E的质量增加2.7 g,F中产生沉淀19.7 g。则该蓝绿色固体的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com