
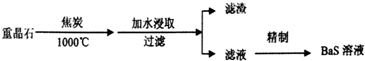

分析 I.(1)BaS是强碱弱酸盐,硫离子能水解;
(2)根据元素守恒可知,制BaS时,重晶石与焦炭在高温锻烧时会产生一种还原性气体应为CO,根据反应中的元素的化合价的变化判断氧化剂和还原剂的物质的量之比,并可计算出电子转移数目;
II.(3)用硝酸与BaS反应制硝酸钡,硝酸受热易分解,据此分析;
(4)硝酸与BaS反应生成硫化氢和硝酸钡,硫化氢有还原性,能与硝酸反应,为防止这些副反应发生,要及时将生成的硫化氢气体排出;Na2S极易水解而变质,Na2S水解呈碱性,所以为防止其变质就要抑制其水解;
(5)根据题中数据,硝酸钡的溶解度随着温度的增大而增大,所以从溶液中获得硝酸钡固体可以用降温结晶的方法.
解答 解:I.(1)BaS是强碱弱酸盐,硫离子能水解使溶液呈碱性,反应的离子方程式为S2-+H2O?HS-+OH-,
故答案为:S2-+H2O?HS-+OH-;
(2)根据元素守恒可知,制BaS时,重晶石与焦炭在高温锻烧时会产生一种还原性气体应为CO,反应的方程式为BaSO4+4C=BaS+4CO↑,反应中硫元素的化合价降低,碳元素的化合价升高,所以BaSO4是氧化剂,C是还原剂,它们的物质的量之比为1:4,硫从+6价变为-2价,所以每有lmol BaSO4反应,转移的电子数目为8NA,
故答案为:1:4;8NA;
II.(3)用硝酸与BaS反应制硝酸钡,硝酸受热易分解,所以反应温度不宜过高,
故答案为:防止浓硝酸受热分解;
(4)硝酸与BaS反应生成硫化氢和硝酸钡,硫化氢有还原性,能与硝酸反应,所以三颈烧瓶内维持低压的目的是降低H2S溶解度,使气体能及时挥发出来,防止发生副反应,Na2S极易水解而变质,所以在溶液中加适量的NaOH,可以防止其变质,
故答案为:降低H2S溶解度,使气体能及时挥发出来,防止发生副反应;NaOH;
(5)根据题中数据,硝酸钡的溶解度随着温度的增大而增大,所以从溶液中获得硝酸钡固体可以用降温结晶的方法,其操作为溶液经蒸发浓缩、冷却结晶、过滤、冰水洗涤、干燥后可获得纯净的Ba(NO3)2晶体,故答案为:蒸发浓缩;冷却结晶.
点评 本题考查学生在“工艺流程阅读、相关反应化学方程式书写、化学反应条件控制的原理”等方面对元素化合物性质及其转化关系的理解和应用程度,综合考查学生对新信息的处理能力、分析能力和实验能力,题目难度中等,注意把握实验原理和方法.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:解答题
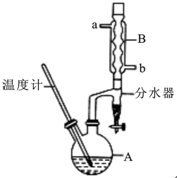 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$CH3CH2CH2CH2)2O,反应物和产物的相关数据如下表:| 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中的溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的能量一定高于N | |
| B. | X、Y的能量总和高于M、N的能量总和 | |
| C. | 因为该反应为放热反应,故不必加热就可发生 | |
| D. | 断裂X、Y的化学键所吸收的能量高于形成M、N的化学键所放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 | |
| D. | 将SO2通入品红溶液中,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质在酶的作用下水解的最终产物为氨基酸 | |
| B. | 向蛋白质溶液加入(NH4)2SO4浓溶液,会使其变性 | |
| C. | 天然蛋白质仅由碳、氢、氧、氮四种元素组成 | |
| D. | 氨基酸和蛋白质都是只能和碱反应的酸性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:2 | C. | 2:3 | D. | 3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
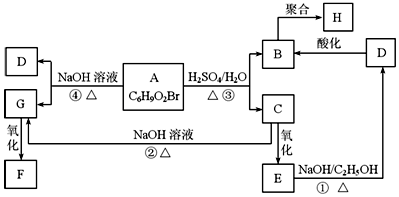 有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基.
有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.有关数据列表如下:
实验室用少量的溴和足量的乙醇、浓硫酸制备1,2-二溴乙烷的装置如图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.有关数据列表如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com