
【题目】硫及其化合物对人类的生产和生活有着重要的作用。
(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2kJ·mol-1
BaS(s)=Ba(s)+S(s) ΔH=+460kJ·mol-1
已知:O2(g)+2C(s)=2CO(g) ΔH=-221kJ·mol-1,
写出O2氧化Ba(s)和S(s)至BaSO4的热化学方程式___________________。
(2)一定条件下,通过下列反应可实现燃煤烟气中硫的回收:2CO(g)+SO2(g)![]() 2CO2(g)+S(l) △H<0。若向2L恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
2CO2(g)+S(l) △H<0。若向2L恒容密闭容器中通入2molCO和1molSO2,反应在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示
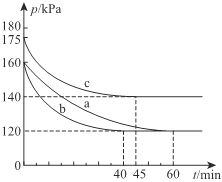
①与实验a相比,c组改变的实验条件可能是______________,判断的依据是______________________。
②用P0表示开始时总压强,P表示平衡时总压强,用α表示SO2的平衡转化率,则α的表达式为______________________。
(3)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)![]() SO3(g)+NO(g) ΔH=-42kJ·mol-1。
SO3(g)+NO(g) ΔH=-42kJ·mol-1。
在1 L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如下:
实验 编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(SO2) | n(NO2) | n(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T2 | 0.20 | 0.30 | a |
①实验甲中,若2 min 时测得放出的热量是4.2 kJ,则0~2 min时间内,用SO2 (g)表示的平均反应速率υ(SO2)=__________,该温度下的平衡常数为______________。
②实验丙中,达到平衡时,NO2的转化率为_______________。
③由表中数据可推知,T1_____T2(填“>”“<”或“=”),判断的理由是____________________。
【答案】 Ba(s)+S(s)+2O2(g) = BaSO4(s) ΔH=-1473.2kJmol-1 升高温度 实验c与a相比,反应速率快,平衡向逆反应方向移动(其他合理答案也给分) ![]() 0.05 mol·L-1·min-1 2.613 40% < T1时,该反应的平衡常数K1=2.613,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2。(其他合理答案也给分)
0.05 mol·L-1·min-1 2.613 40% < T1时,该反应的平衡常数K1=2.613,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2。(其他合理答案也给分)
【解析】试题分析: (1)根据盖斯定律书写O2氧化Ba(s)和S(s)至BaSO4的热化学方程式; (2)同体积、同物质的量,温度越高压强越大,实验c,反应速率快;根据同温、同体积,压强与物质的量成正比分析;(3) ①根据2 min 时放出的热量是4.2 kJ,可计算消耗SO2的物质的量;根据表格数据,利用三段式计算平衡常数;②乙、丙温度相同,根据平衡常数相同计算丙中NO2的转化率为;根据甲、乙的平衡常数判断T1、T2的大小;
解析:①BaSO4(s)+4C(s) = BaS(s)+4CO(g)ΔH=+571.2kJ·mol-1
②BaS(s) = Ba(s)+S(s)ΔH=+460kJ·mol-1
③O2(g)+2C(s)=2CO(g)ΔH=-221kJ·mol-1,根据盖斯定律,③×2-①-②得 O2氧化Ba(s)和S(s)至BaSO4的热化学方程式Ba(s)+S(s)+2O2(g) = BaSO4(s) ΔH=-1473.2kJmol-1 ;(2)同体积、同物质的量,温度越高压强越大,根据图示,实验c,反应速率快,平衡向逆反应方向移动;所以c改变的条件是升高温度; ;

![]() ,x=3
,x=3![]() ,SO2的平衡转化率是(3
,SO2的平衡转化率是(3![]() )÷1×100%=
)÷1×100%=![]() ;
;
(3) 2 min 时放出的热量是4.2 kJ,根据热化学方程式,消耗SO2的物质的量![]() ;则用SO2 (g)表示的平均反应速率υ(SO2)=
;则用SO2 (g)表示的平均反应速率υ(SO2)=![]() 0.05 mol·L-1·min-1,
0.05 mol·L-1·min-1,

。
甲的平衡常数为![]() 2.613;
2.613;
乙的平衡常数
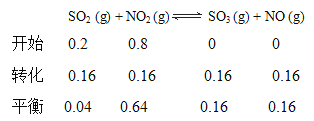
乙的平衡常数为![]() 1;
1;
设丙中二氧化硫的转化量为a
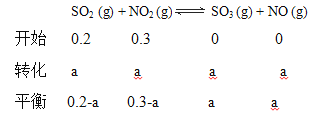
乙、丙温度相同,平衡常数相同![]() ,
,
a = 0.12,
二氧化硫的转化率=0.12÷0.2×100%=60%;
③正反应放热,升高温度平衡逆向移动,平衡常数减小,甲的平衡常数大于乙的平衡常数,,T1<T2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关水在人体中的作用的说法不正确的是
A. 在人体内分解会放出热量 B. 能调节人体体温
C. 是人体内进行生化反应的介质 D. 在人体内是一种良好的溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、 下列各组物质:①O2和O3 ②H2、D2、T2 ③12 C和14 C ④CH3CH2CH2CH3和(CH3)2CHCH3 ⑤癸烷和十六烷 ⑥CH3(CH2)5CH3和CH3CH2CH2CH(CH3)C2H5 (在横线上填相应的序号)
A、互为同位素的是_________ ;B、互为同分异构体的是________;
C、互为同素异形体的是________;D、同一种物质的是_________。
Ⅱ.写出下列反应的化学方程式,并注明反应类型
①乙烯通入到溴的四氯化碳溶液中:_____________________,反应类型___________。
②苯与浓硝酸、浓硫酸混合后加热至50℃~60℃发生反应:__________________,反应类型 ___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol L-1的HC1溶液,测得溶液中某几种离子的物质的量的变化情况如图所示。下列说法不正确的是

A. b和c曲线表示的离子反应均为CO32-+H+= HCO3-
B. 结合H+的能力:AlO2->CO32-> HCO3->Al(OH)3
C. M点时A1(OH)3的质量等于3.9 g
D. 原混合溶液中,CO32-与AlO2-的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示常温下,将SO2气体通入溴水中,所得溶液pH的变化
B. 图2表示向NH4A1(SO4)2溶液中逐滴滴入NaOH溶液,沉淀总物质的量(n)随NaOH溶液体积(V)的变化
C. 图3表示T °C时,对于可逆反应:A(g)+B(g)![]() 2C(g) +D(g)ΔH>0,正、逆反应速率与压强的关系
2C(g) +D(g)ΔH>0,正、逆反应速率与压强的关系
D. 图4表示常温下,几种难溶氢氧化物的饱和溶液中金属离子浓度的负对数与溶液PH的关系,则在pH = 7的溶液中,Fe3+、A13+、Fe2+能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1mol SO42﹣的质量是96 g
B.1mol H2O的质量是18 g/mol
C.CO2的摩尔质量是44 g
D.HCl的相对分子质量是36.5 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一些物质之间的转化关系,其中部分反应中反应物或生成物未列全。已知A、H、I、K均为家庭厨房中的常见物质,其中A是食品调味剂,H是消毒剂的有效成分,I、K可用作食品发泡剂。B是一种有机酸盐,E、F、G均为氧化物,L是红褐色沉淀。

根据以上信息,回答下列问题:
⑴H的化学式为____________________________。
⑵ A的电子式___________________________________________。
⑶ G→J的离子方程式为________________________________________________________________。
⑷ M是含氧酸盐,化学式为Na2FeO4,则反应①的化学方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用右图所示实验装置(夹持仪器己略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是
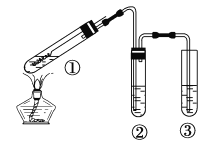
A. 上下移动①中铜丝可控制SO2的产生与停止
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认有CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com