
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)硅主要以硅酸盐、____________等化合物的形式存在于地壳中。
(2)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以________相结合,其晶胞中共有8个原子,其中在面心位置贡献________个原子。
(3)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为______________________________________。
(4)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能/ (kJ·mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是________________________________________________________________________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是________________________________
________________________________________________________________________。
(5)在硅酸盐中,SiO 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为__________,Si与O的原子数之比为__________,化学式为__________。
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为__________,Si与O的原子数之比为__________,化学式为__________。

解析 (1)硅在自然界中主要以硅酸盐和二氧化硅等化合物的形式存在于地壳中。
(2)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以硅硅共价键相结合,其晶胞中共有8个原子,其中在面心位置的是6个原子,每个面心原子贡献二分之一,所以6个面心原子对该晶胞贡献3个原子。
(3)根据题意:工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl===SiH4+4NH3+2MgCl2。
(4)①分析表格中C—C键、C—H键、Si—Si键、Si—H键的键能,可以得出:C—C键和C—H键较强,所形成的烷烃稳定,而硅烷中Si—Si键和Si—H键的键能较低,易断裂,导致长链硅烷难以生成,所以硅烷在种类和数量上都远不如烷烃多;②分析表格中C—H键、C—O键、Si—H键、Si—O键的键能,可以得出:C—H键的键能大于C—O键,C—H键比C—O键稳定,而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键,所以SiH4的稳定性小于CH4,更易生成氧化物。
(5)图(b)为一种无限长单链结构的多硅酸根,其中每个Si原子和4个氧原子形成四面体结构,故Si原子杂化方式为sp3,Si与O原子数之比为1∶3,化学式为[SiO3] (或SiO
(或SiO )。
)。
答案 (1)二氧化硅 (2)共价键 3 (3)Mg2Si+4NH4Cl===SiH4+4NH3+2MgCl2 (4)①C—C键和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂。导致长链硅烷难以生成 ②C—H键的键能大于C—O键,C一H键比C—O键稳定。而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键 (5)sp3 1∶3 [SiO3] (或SiO
(或SiO )
)


科目:高中化学 来源: 题型:
A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是________,写出一种工业制备单质F的离子方程式:__________________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为__________,其水溶液与F单质反应的化学方程式为____________________________________________;在产物中加入少量KI,反应后加入CCl4并振荡,有机层显______色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1∶1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为________;b的化学式为______________;c的电子式为________;d的晶体类型是________。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过________键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是元素周期表的一部分,下列说法正确的是( )
A.可在灰色区域“甲”中寻找催化剂
B.离子半径:W-﹥X+﹥Y3-
C.气态氢化物的稳定性:Z﹥W
D.工业上电解X和W化合物的水溶液制备X

查看答案和解析>>
科目:高中化学 来源: 题型:
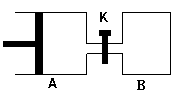
如图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)  Z(g)+2W(g),
Z(g)+2W(g),
达到平衡时V(A)=1.2aL。试回答:
⑴A中X的转化率为 。
⑵A、B中X转化率大小关系为A B(填“>”、“<”、“=” )
⑶打开K,一段时间后又达到新的平衡时,A的体积为 L(连通管中气体体积不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)===Cu2+(aq)+H2(g)
ΔH=+64.39 kJ·mol-1
2H2O2(l)===2H2O(l)+O2(g)
ΔH=-196.46 kJ·mol-1
H2(g)+ O2(g)===H2O(l)
O2(g)===H2O(l)
ΔH=-285.84 kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热ΔH等于
A.-417.91 kJ·mol-1 B.-319.68 kJ·mol-1
C.+546.69 kJ·mol-1  D.-448.46 kJ·mol-1
D.-448.46 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用如图所示装置进行化学反应X+2Y===2Z能量变化情况的研究。当往试管中滴加试剂Y时,看到试管中甲处下降,乙处上升。下列关于该反应的叙述正确的是
①该反应为放热反应;②生成物的总能量比反应物的总能量高;③该反应过程可以看成是“贮存”于X、Y内部的能量转化为热量而释放出来。
A.①②③ B.①③
C.①② D.③

查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿弗加德罗常数,下列说法正确的是
A.0.2 mol H2O2完全分解转移的电子数为0.4NA
B.300 mL 2 mol·L-1的蔗糖溶液中所含分子数为0.6NA
C.在标准状况下,2.8g N2和2.8g CO所含电子数均为1.4NA
D.在常温常压下,2.24L SO2与O2混合气体中所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g样品加热,其质量变为w2 g,则该样品的纯度(质量分数)是( )
A.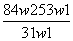 B.
B.
C. D.
D.
A
解析:设样品中含NaHCO3x g,
2NaHCO3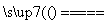 Na2CO3+CO2↑+H2O Δm
Na2CO3+CO2↑+H2O Δm
2×84 106 62
x w1-w2
x= (g),
(g),
则Na2CO3的质量分数为: =
=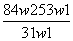 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com