
【题目】将NaAlO2、Ba(OH)2、NaOH配成100.0 mL混合溶液,向该溶液中通入足量CO2,生成沉淀的物质的量n(沉淀),与通入CO2的体积(标准状况下)V(CO2)的关系,如下图所示,

下列说法中正确的是( )
A. P点的值为12.32
B. 混合溶液中c(NaOH)+c(NaAlO2)=4.0 mol/L
C. bc段的化学反应方程式为:NaOH+CO2=NaHCO3
D. cd段表示Al(OH)3沉淀溶解
【答案】B
【解析】开始通入CO2,二氧化碳与氢氧化钡反应有沉淀BaCO3产生;将Ba(OH)2消耗完毕,接下来消耗NaOH,因而此段不会产生沉淀(即沉淀的量保持不变);NaOH被消耗完毕,接下来二氧化碳与偏铝酸钠反应生成氢氧化铝沉淀;又因二氧化碳足量,还可以继续与上面反应的产物Na2CO3反应,沉淀量不变,继续与BaCO3反应,沉淀减少,最后剩余沉淀为Al(OH)3。
A. 根据上述分析,b点对应的溶液中含有碳酸钠,c点对应的溶液中含有碳酸氢钠,d点对应的溶液中含有碳酸氢钠和碳酸氢钡,溶解碳酸钡消耗的二氧化碳为22.4L-15.68L=6.72L,物质的量为![]() =0.3mol,因此原混合溶液中含有0.3mol Ba(OH)2;c点对应的溶液中含有碳酸氢钠,根据碳元素守恒,生成碳酸氢钠和碳酸钡共消耗
=0.3mol,因此原混合溶液中含有0.3mol Ba(OH)2;c点对应的溶液中含有碳酸氢钠,根据碳元素守恒,生成碳酸氢钠和碳酸钡共消耗![]() =0.7mol二氧化碳,因此碳酸氢钠的物质的量为0.7mol -0.3mol=0.4mol,根据钠元素守恒,混合溶液中n(NaOH)+n(NaAlO2) =0.4 mol,b点消耗的二氧化碳是与NaAlO2、Ba(OH)2、NaOH反应生成碳酸钡,氢氧化铝和碳酸钠的二氧化碳的总量,根据CO2+Ba(OH)2═BaCO3↓+H2O、CO2+2NaOH═Na2CO3+H2O、CO2+3H2O+2NaAlO2═2Al(OH)3↓+Na2CO3可知,n (CO2)=n[Ba(OH)2]+
=0.7mol二氧化碳,因此碳酸氢钠的物质的量为0.7mol -0.3mol=0.4mol,根据钠元素守恒,混合溶液中n(NaOH)+n(NaAlO2) =0.4 mol,b点消耗的二氧化碳是与NaAlO2、Ba(OH)2、NaOH反应生成碳酸钡,氢氧化铝和碳酸钠的二氧化碳的总量,根据CO2+Ba(OH)2═BaCO3↓+H2O、CO2+2NaOH═Na2CO3+H2O、CO2+3H2O+2NaAlO2═2Al(OH)3↓+Na2CO3可知,n (CO2)=n[Ba(OH)2]+ ![]() n(NaOH)+
n(NaOH)+![]() n(NaAlO2)=0.3mol+0.2mol=0.5mol,体积为11.2L,故A错误;B. c点对应的溶液中含有碳酸氢钠,根据碳元素守恒,生成碳酸氢钠和碳酸钡共消耗
n(NaAlO2)=0.3mol+0.2mol=0.5mol,体积为11.2L,故A错误;B. c点对应的溶液中含有碳酸氢钠,根据碳元素守恒,生成碳酸氢钠和碳酸钡共消耗![]() =0.7mol二氧化碳,因此碳酸氢钠的物质的量为0.7mol -0.3mol=0.4mol,根据钠元素守恒,混合溶液中c(NaOH)+c(NaAlO2)=
=0.7mol二氧化碳,因此碳酸氢钠的物质的量为0.7mol -0.3mol=0.4mol,根据钠元素守恒,混合溶液中c(NaOH)+c(NaAlO2)=![]() =4.0 mol/L,故B正确;C. bc段是碳酸钠溶解的过程,反应的化学反应方程式为:Na2CO3+H2O +CO2=2NaHCO3,故C错误;D. cd段是溶解碳酸钡的过程,故D错误;故选B。
=4.0 mol/L,故B正确;C. bc段是碳酸钠溶解的过程,反应的化学反应方程式为:Na2CO3+H2O +CO2=2NaHCO3,故C错误;D. cd段是溶解碳酸钡的过程,故D错误;故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现在我们把无污染、无公害的食品叫做“绿色食品”,而最初,专家把绿色植物通过光合作用转化的食品叫做“绿色食品”,海洋提供的食品叫做“蓝色食品”,通过微生物发酵制得的食品叫做“白色食品”,根据最初的说法,下列属于“蓝色食品”的是( )
A.大米B.海带C.食醋D.西红柿
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2HI(g)![]() H2(g)+I2(g紫色),下列叙述能够说明已达平衡状态的是( )
H2(g)+I2(g紫色),下列叙述能够说明已达平衡状态的是( )
A.混合气体的颜色不再变化
B.温度和体积一定时,容器内压强不再变化
C.1molH-H键生成的同时有2molH-I键断裂
D.各物质的物质的量浓度之比为2∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对炼锌厂的铜镉废渣中各元素进行分离,能减少环境污染,同时制得食品锌强化剂的原料ZnSO4·7H2O实现资源的再利用。其流程图如下。

[相关资料]
①铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
③Zn(OH)2属于两性氢氧化物。
④滤液I中有Fe2+、Zn2+、Cu2+、Cd2+和少量的AsO![]() 。
。
⑤有关离子沉淀完全的pH
金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
请回答下列问题:
(1)提高铜镉废渣浸出率可以采用的方法是(写出其中一点即可)____;
(2)向滤液I中逐滴滴人酸性KMnO4溶液可与AsO![]() 发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
发生反应生成FeAsO4,写出该反应的离子方程式____;加入酸性KMnO4溶液不能过量,判断该滴定终点的现象是____;滤渣Ⅱ中除了FeAsO4外,还有____;
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用试剂为____;
(4)上述流程除了实现对这些元素进行提取分离能减少环境污染,同时制得ZnSO4·7H2O实现资源的再利用,还可以得到副产物___
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池的工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的正极反应式为____;
(6)若a克铜镉废渣含有b molFe元素,加入了c mol KMnO4,则铜镉废渣中As元素的质量分数为____。(不考虑镉元素与KMnO4的反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活中常见物质主要成分的化学式表示正确的是( )
A.铁红—Fe2O3B.漂白粉—NaClO
C.生石灰—Ca(OH)2D.纯碱—NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 等量的氯气分别与足量氢氧化钠和硫化钠充分反应,转移的电子数相同
B. 等量的铜分别与足量浓、稀硝酸充分反应,生成气体的物质的量相同
C. 等量的铝分别与氢氧化钠溶液和盐酸充分反应,生成气体体积一定相同
D. 等量的铁分别与足量氯气和硫充分反应,生成物质的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(物质结构与性质)钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C
2TiCl4+2FeCl3+6CO; TiO2+2Cl2+2C![]() TiCl4+2CO
TiCl4+2CO
将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。请回答下列问题:
(1)基态钛原子的价电子排布式为 。
(2)与CO互为等电子体的离子为 (填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp1杂化的分子有 。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于 (填“原子”、“分子”或“离子”)晶体。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是 ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 。
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如右图所示,则其中Ti4+的配位数为 。
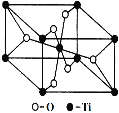
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X可能含有Fe2+、A13+、NH4+、CO32-、SO32-、SO42-、C1-中的若干种,现取X溶液进行连续实验,实验过程及产物如图.说法正确的是

A. X中肯定存在Fe2+、A13+、NH4+、SO42- B. X中不能确定的离子是 A13+和C1-
C. 沉淀I一定是Al(OH)3 D. 溶液E和气体F不能发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:
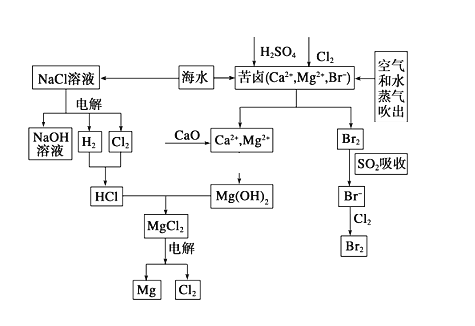
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式) ______________________。
(2)①电解饱和食盐水的化学反应方程式为______________。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是_______________。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生的离子方程式_________,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为__________________。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_____________;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用_____________方法得到单质Br2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com