
| A. | 反应速率与SO42-浓度有关 | |
| B. | 催化剂能加快化学反应速率,但反应物所需活化能不变 | |
| C. | 碘单质是过氧化氢分解的催化剂 | |
| D. | 与一定量H2O2反应的KI溶液浓度越大,反应速率越慢 |
分析 A.在反应①中SO42-不参与反应;
B.催化剂能降低反应物的活化能;
C.碘在反应②中是反应物、③中是生成物;
D.碘是催化剂,且碘浓度与KI浓度成正比.
解答 解:A.在反应①中SO42-不参与反应,所以硫酸根离子浓度大小不影响反应速率,故A错误;
B.催化剂能降低反应物的活化能,增大活化分子百分数,加快化学反应速率,故B错误;
C.碘在反应②中是反应物、③中是生成物,所以碘在过氧化氢的分解中作催化剂,故C正确;
D.碘是催化剂,且碘浓度与KI浓度成正比,所以与一定量双氧水反应的KI溶液浓度越大,反应速率越快,故D错误;
故选C.
点评 本题考查化学反应速率影响因素,为高频考点,侧重考查学生分析判断能力,明确该反应实质、反应速率影响原理是解本题关键,易错选项是A,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、Cl-、NO3- | B. | Na+、Ba2+、SO32-、ClO- | ||
| C. | Fe2+、K+、SO42-、NO3- | D. | Na+、Fe3+、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
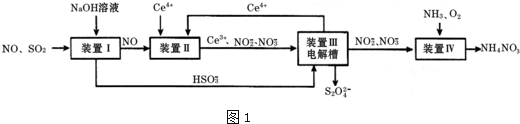
 .
.
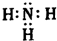 .化合物X的电子式
.化合物X的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | CO2 | C. | H2S | D. | HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
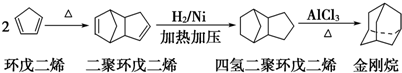
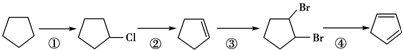
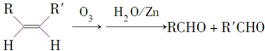 ,请写出下列反应产物的结构简式:
,请写出下列反应产物的结构简式: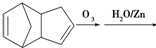
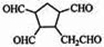 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式为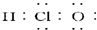 | |
| B. | 将混有HCl的Cl2通入饱和NaHCO3溶液中除去HCl | |
| C. | 将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 | |
| D. | 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、NO2都能与NaOH溶液反应,都是酸性氧化物 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | 为增大氯水中c(HClO),应采取的措施是加入CaCO3固体 | |
| D. | 铁、铝容器常温下可盛放浓硫酸,是因为常温下铁、铝与浓硫酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol甲醇中含有C-H键的数目为4NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA | |
| C. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| D. | 1mol丙烯酸中含有双键的数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com