
下列各种叙述中,正确的是 ( )
①Cl-和Cl2的性质相同;②ClO3-具有氧化性;③Cl-比Cl多一个电子;④Cl-具有酸性; ⑤盐酸兼有酸性、氧化性、还原性; ⑥Cl2的氧化性比盐酸的强;⑦Cl2只有氧化性而没有还原性
A.①②⑤⑥ B. ①②④⑥
C. ②③⑤⑥ D. ②③⑦
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
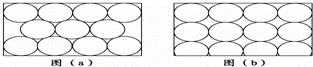
金属原子在二维空间里的放置如图所示的两种方式,下列说法中正确的是( )
|
| A. | 图(a)为非密置层,配位数为6 |
|
| B. | 图(b)为密置层,配位数为4 |
|
| C. | 图(a)在三维空间里堆积可得六方最密堆积和面心立方最密堆积 |
|
| D. | 图(b)在三维空间里堆积仅得简单立方 |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应m A+n B⇌p C在某温度下达到平衡.
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是 .
②若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向 方向移动.
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为 态.
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐是一种强氧化剂,在能源、环保等方面均有广泛的用途。湿法、干法制备高铁酸钾的原理如表所示:
| 湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |
(1)某工厂用湿法制备高铁酸钾的流程如图所示:
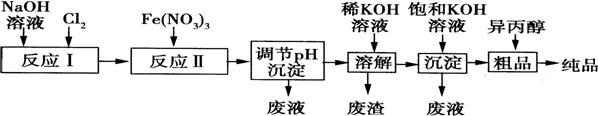
①反应I的化学方程式为 。
②反应Ⅱ的离子方程式为 。
③已知25℃时Fe(OH)3的Ksp=4.0×10—38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10—5mol·L—1.则需调整
pH= 时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾。
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2 (填“强”或“弱”)。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为 。
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知a为ⅡA族元素,b为ⅢA族元素,它们的原子序数分别为m和n,且a、b为同一周期元素,下列关系错误的是 ( )
A. n=m+10 B. n=m+11
C. n=m+25 D. n=m+1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于卤素的叙述正确的是 ( )
A、随核电荷数增加卤素原子非金属性增强
B、随核电荷数增加,单质熔沸点升高
C、随核电荷数增加,单质氧化性增强
D、单质与水反应,均可用通式X2+H2O=HX+HXO表示
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是一种可再生燃料。在容积为2L的密闭容器中进行反应:CO(g)+2H2(g)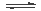 CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示。
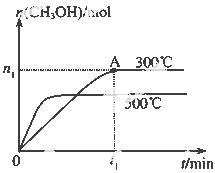
(1)该反应的△H 0 (填>、<或=)
(2)300℃时,0-t1 min内 CH3OH的平均生成速率为
(3)若要提高甲醇的产率,可采取的措施有_________ 。(填字母)
A.缩小容器体积 B.降低温度
C.升高温度 D.使用合适的催化剂
E.甲醇从混合体系中分离出来
(4)300℃时,CO、H2的起始物质的量分别为2mol和3mol,若图中n1数据为0.5mol,试计算300℃下,该反应的平衡常数(写出计算过程,保留两位有效数字)
(5)工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,若有440g CO2与H2恰好完全反应生成甲醇和水,放出495kJ的热量,试写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,下列关于实验现象的描述正确的是 ( )
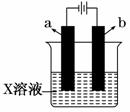
| a电极 | b电极 | X溶液 | 实验现象 | |
| A | 石墨 | 石墨 | CuCl2 | a电极质量增加,b电极放出无色气体 |
| B | Fe | 石墨 | KNO3 | a电极质量增加,b电极放出无色气体 |
| C | Fe | Cu | CuSO4 | a电极质量增加,b电极质量减少 |
| D | 石墨 | 石墨 | HCl | a电极放出无色气体,b电极放出无色气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com