
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
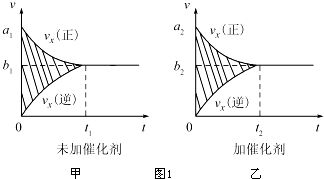
分析 (1)①加入催化剂,正逆反应速率都增大,达到平衡所用时间较少,但平衡不移动;
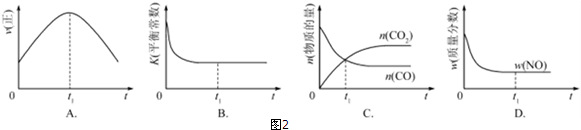
②A.到达平衡后正、逆速率相等,不再变化;
B.到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
C.t1时刻后二氧化碳、CO的物质的量发生变化,最后不再变化;
D.到达平衡后各组分的含量不发生变化;
(2)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
(3)①温度升高,平衡常数增大即平衡向正反应方向移动;
②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,计算平衡浓度,结合平衡常数的表达式计算;
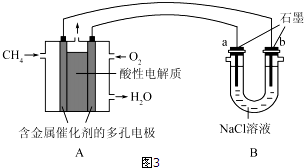
(4)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+;
②根据电解氯化钠溶液的电解方程式来求溶液的PH;
③电解过程中,阳极先生成氯气,之后电解水过程中生成氧气,根据氢气的总物质的量判断阳极生成气体的总物质的量,然后计算出标况下的阳极生成气体的体积.
解答 解:(1)①加入催化剂,正逆反应速率都增大,达到平衡所用时间较少,但平衡不移动,则图象阴影部分面积不变,
故答案为:BC;
②A.到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B.该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故B正确;
C.t1时刻后二氧化碳、CO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D.NO的质量分数为定值,t1时刻处于平衡状态,故D正确,
故答案为:BD;
(2)已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol①
2NO2(g)?N2O4(g)△H2=-56.9kJ/mol②
H2O(g)=H2O(l)△H=-44.0kJ/mol③
根据盖斯定律,①-②+④×2可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),故△H=-867kJ/mol-(-56.9kJ/mol)+2(-44.0)kJ/mol=-898.1kJ/mol 即CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol,
故答案为:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol;
(3)①温度升高,平衡常数增大即平衡向正反应方向移动,故该反应为吸热反应,
故答案为:吸热;
②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5mol•L-1,该温度K=$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})•c({H}_{2}O)}$=$\frac{0.5×1.{5}^{3}}{0.5×0.5}$=6.75,
故答案为:6.75;
(4)①、原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+,负极电极反应式为:CH4-8e-+2H2O=CO2+8H+,
故答案为:CH4-8e-+2H2O=CO2+8H+;
②100mL 1mol/L食盐水中含有氯化钠0.1mol,根据反应方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑可知,电解0.1molNaCl生成0.1mol氢氧化钠和0.05mol氢气,同时生成0.05mol氯气;继续电解实质为电解水,标况下2.24L氢气的物质的量为0.1mol,电解水生成0.05mol氢气会生成0.025mol氧气,及电解过程中阳极总共生成0.075mol气体,
电解生成标况下2.24L氢气时,NaCl完全电解,生成0.1molNaOH,溶液体积为0.1L,则c(OH-)=1mol/L,c(H+)=10-14,所以PH=14,
故答案为:14;
③根据②的分析可知,电解过程中阳极生成了0.05mol氯气和0.025mol氧气,总共生成0.075mol气体,标准状况下阳极生成气体的体积为:22.4L/mol×0.075mol=1.68L,
故答案为:1.68.
点评 本题考查了化学平衡常数影响因素及计算、电解原理、热化学方程式的书写等知识,题目难度较大,试题涉及的知识点较多,充分培养了学生的分析、理解能力及化学计算能力,注意掌握化学平衡常数的概念、表达式及其影响因素,明确电解原理,能够正确书写电极反应式.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
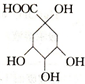
| A. | 1mol X能与5mol NaOH反应 | B. | X能发生加成、取代、氧化反应 | ||
| C. | X的分子式为C7H8O6 | D. | X与乙酸、乙醇均能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g CO、C2H4混合气体的分子总数NA,体积约为22.4L | |
| B. | 9.2g金属钠投入到足量的重水中所得气体中含有0.4NA中子 | |
| C. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 0.1mol/LFeCl3溶液中所含Fe3+的数目小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
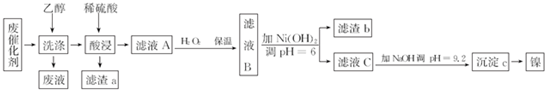
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试验编号 | 温度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究探究温度不同对反应速率的影响 b.实验1和3探究反应物浓度对该反应速率的影响. c.实验2和4探究催化剂对反应速率的影响 | |
| 体积(mL) | 浓度(mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |

| 试验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
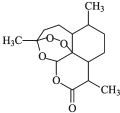 2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )
2015年,中国科学家屠呦呦因发现治疗疟疾的药物青蒿素获得了诺贝尔奖.青蒿素的结构如图所示,下列有关青蒿素的说法中正确的是( )| A. | 分子式为C15H20O5 | B. | 具有较强的还原性 | ||
| C. | 易溶于水,乙醇和乙醚 | D. | 氧原子的化合价由-1和-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用热的纯碱水洗手时更容易除去手上的油脂污垢 | |
| B. | 若发现厨房内天然气发生了泄漏,应立即打开门窗 | |
| C. | 用无水硫酸铜检验酒精中含有水的过程中发生了化学变化 | |
| D. | 抗战胜利70周年阅兵式上释放的气球中充入的是氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3 是酸性氧化物,能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | 金属氧化物一定是碱性氧化物 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com