
【题目】钛(![]() )被称为继铁、铝之后的第三金属,钛白(
)被称为继铁、铝之后的第三金属,钛白(![]() )是目前使用最广泛的白色颜料。制备
)是目前使用最广泛的白色颜料。制备![]() 和
和![]() 的原料是钛铁矿,用含
的原料是钛铁矿,用含![]() 的钛铁矿(主要成分为
的钛铁矿(主要成分为![]() )制备
)制备![]() 的流程如下:
的流程如下:
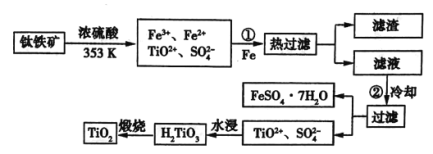
(1)步骤①加![]() 的目的是__________________;步骤②冷却的目的是_____________。
的目的是__________________;步骤②冷却的目的是_____________。
(2)考虑成本和废物的综合利用等因素,水浸后的废液中应加入______________处理。
(3)由金红石(![]() )制取单质钛(
)制取单质钛(![]() )的过程为
)的过程为![]() ,其中反应
,其中反应![]() 在氩气气氛中进行的理由是____________。
在氩气气氛中进行的理由是____________。
【答案】将![]() 还原为
还原为![]() 析出绿矾(
析出绿矾(![]() ) 碳酸钙(其它合理答案也可) 高温下镁和钛会与
) 碳酸钙(其它合理答案也可) 高温下镁和钛会与![]() 、
、![]() 反应,因此只能用稀有气体来保护
反应,因此只能用稀有气体来保护
【解析】
钛铁矿溶于浓硫酸,所有金属转变为自由离子,加入铁粉可以将![]() 还原为
还原为![]() ,此时热过滤除去过量的铁粉,再冷却使绿矾大量析出,过滤后可得绿矾,此时溶液中剩下的钛元素,经水浸后转变为偏钛酸
,此时热过滤除去过量的铁粉,再冷却使绿矾大量析出,过滤后可得绿矾,此时溶液中剩下的钛元素,经水浸后转变为偏钛酸![]() ,灼烧失水后即可得到钛白粉
,灼烧失水后即可得到钛白粉![]() 。
。
(1)分析题图可知,钛铁矿中的铁最终转化成副产品绿矾,所以要将+3价![]() 转化为+2价
转化为+2价![]() ;降低温度是为了减小
;降低温度是为了减小![]() 的溶解度,利于绿矾结晶析出;
的溶解度,利于绿矾结晶析出;
(2)水浸过程发生的离子反应为![]() ,废液呈酸性,可以考虑向水浸后的废液中加入
,废液呈酸性,可以考虑向水浸后的废液中加入![]() 等物质(合理即可);
等物质(合理即可);
(3)由于![]() 和
和![]() 易与空气中的
易与空气中的![]() 、
、![]() 等反应;故该反应要在氩气气氛中进行。
等反应;故该反应要在氩气气氛中进行。


科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为![]() ,还含有杂质
,还含有杂质![]() 和
和![]() )提取氧化铝并冶炼
)提取氧化铝并冶炼![]() 的操作过程如下:
的操作过程如下:
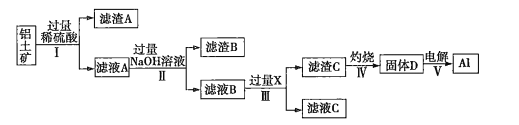
(1)滤渣A是______,滤渣B是__________。
(2)操作Ⅰ、Ⅱ、Ⅲ的名称是____________。
(3)生成滤渣C的离子方程式为___________________________________________。
(4)取100 mL滤液B,加入200mL 1.0 ![]() 的盐酸时,沉淀量达到最大且质量为11.7g。则滤液B中
的盐酸时,沉淀量达到最大且质量为11.7g。则滤液B中![]() ________,
________,![]() _______
_______ ![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外学习小组对日常生活中不可缺少的调味品M进行探究。已知C可在D中燃烧发出苍白色火焰。M与其他物质的转化关系如图所示(部分产物已略去):

(1)写出B的电子式________。
(2)写出由M溶液制B、C、D的化学方程式___________________________________。
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,写出A和B水溶液反应的离子方程式___________________________________。
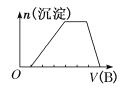
(4)若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,生成的CO2物质的量与所用盐酸体积如图所示,则A与B溶液反应后溶液中溶质的化学式为_______。

(5)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是_________________________________。
(6)若A是一种氮肥, A和B反应可生成气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式为________________。
(7)若A是一种溶液,可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32- 、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图所示,由此可知,该溶液中肯定含有的离子的物质的量浓度之比为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铝热反应的现象有如下描述:反应放出大量的热,并发出耀眼的光芒;纸漏斗的下部被烧穿,有熔融物落入沙中。已知![]() 、
、![]() 、
、![]() 、
、![]() 的熔点、沸点如表所示:
的熔点、沸点如表所示:
物质 |
|
|
|
|
熔点/℃ | 660 | 1565 | 2054 | 1535 |
沸点/℃ | 2467 | 3414 | 2980 | 2750 |
(1)某同学推测,铝热反应所得到的熔融物是铁铝合金,因为该反应放热能使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验,证明上述熔融物中含有金属铝,填写下列表格:
①所用试剂 | ______ |
②实验操作及现象 | ______ |
③有关反应的化学方程式 | ______ |
(3)欲在常温下溶解该熔融物,下列试剂中最好选用______(填序号),理由是_________________________。
a.浓硫酸 b.稀硫酸 c.硫酸锌溶液d. ![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2。A的核磁共振氢谱有4个峰且面积之比为1∶2∶2∶3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图。关于A的下列说法中,不正确的是( )

A.A属于芳香化合物
B.A的结构简式为![]()
C.A属于羧酸类化合物
D.在红外光谱图中可以获得分子中含有的化学键或官能团的信息
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又是电动公交车的清洁能源,利用水煤气在一定条件下含成甲醇,发生的反应为:![]() ?
?![]() 已知CO、
已知CO、![]() 、
、![]() 的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol,则
的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol,则![]() ______。
______。![]() 在一容积为2L的恒容密闭容器中加入
在一容积为2L的恒容密闭容器中加入![]() CO和
CO和![]()
![]() ,发生如下反应:CO
,发生如下反应:CO![]() ,实验测得
,实验测得![]() 和
和![]() 下,甲醇的物质的量随时间的变化如表所示,下列说法正确的是
下,甲醇的物质的量随时间的变化如表所示,下列说法正确的是
时间 | 10min | 20min | 30min | 40min | 50min | 60min |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]() 由上述数据可以判断:
由上述数据可以判断:![]() ______
______![]()
![]() 时,
时,![]() 的平均反应速率
的平均反应速率![]() ______。
______。![]() 该反应
该反应![]() 达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是______
达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是______![]() 选填编号
选填编号![]() 。
。
A 改用高效催化剂![]() 升高溫度
升高溫度![]() 缩小容器体积
缩小容器体积 ![]() 分离出甲醇
分离出甲醇 ![]() 增加CO的浓度
增加CO的浓度![]() 若保持
若保持![]() 不变,起始时加入CO、
不变,起始时加入CO、![]() 、
、![]() 的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件______。
的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件______。![]() 当反应在
当反应在![]() 达到20min时,控制体积不变,迅速将
达到20min时,控制体积不变,迅速将![]() ,
,![]() ,
,![]() 同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出20~40min内容器中
同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出20~40min内容器中![]() 浓度的变化趋势曲线:______
浓度的变化趋势曲线:______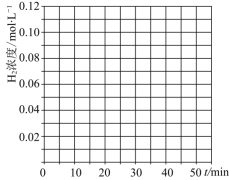
![]() 在以
在以![]() 为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为______;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。
为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为______;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。![]() 燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比
燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是一个严重缺水的国家,污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的是

A. 电流方向从A极沿导线经小灯泡流向B极
B. B极为电池的阳极,电极反应式为CH3COO—— 8e + 4H2O ═ 2HCO3—+9H+
C. 当外电路中有0.2 mol e转移时,通过质子交换膜的H+的个数为0.2NA
D. A极的电极反应式为![]() + H++2e ═ Cl+
+ H++2e ═ Cl+ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)CH3OH(g) ΔH1= -90 kJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g) ΔH2= -41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________。
(2)在容积为VL的容器中充入amol CO与2amol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。
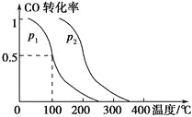
①p1 ________ p2(填“大于”、“小于”或“等于”);
②在温度、体积不变的情况下,再增加amol CO与2amol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”),平衡常数_____(填“增大”、“减小”或“不变”)。
(3)已知在T℃时,CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,此时刻υ正 ______υ逆 (填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物广泛应用于高新材料领域,请回答下列有关问题:
(1)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图)。
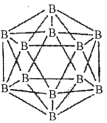
①在基态11B原子中,核外存在______对自旋相反的电子。
②若每个单元中有两个原子为l0B,其余为11B,则该单元结构的类型有______种。
(2)NaBH4是一种重要的储氢载体,其中涉及元素的电负性由小到大的顺序为________,BH4-离子的空间构型是_____________,与BH4-互为等电子体的的分子有___________。
(3)硼酸(H3BO3)为白色片状晶体,有与石墨相似的层状结构,则硼酸晶体中存在的作用力有共价键、_____、_______。与H3BO3酸性最接近的是__________(填字母)。
A.H4SiO4 B.H3PO4 C.HNO2
(4)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。如图是磷化硼晶体的晶胞,B原子的杂化方式是___________。立方相氮化硼晶体的熔点要比磷化硼体高,其原因是_____________。

(5)己知磷化硼的晶胞参数a=478 pm,请列式计算该晶体的密度p=_____g.cm-3(用含NA的代数式表示即可,不需要计算出结果)。晶胞中硼原子和磷原子最近的核间距为_________pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com