
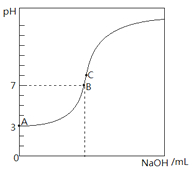
 常温下,下图是用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L HA溶液所得到滴定曲线.下列相关的说法错误的是( )
常温下,下图是用0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/L HA溶液所得到滴定曲线.下列相关的说法错误的是( )| A、由图可知HA是一种弱酸,且Ka=1.0×10-5 |
| B、滴定到B点时,c(Na+)=c(A-) |
| C、当NaOH溶液的体积为10.00mL时,有c(A-)+c(OH-)=c(H+)+c(HA) |
| D、C点溶液中的离子浓度关系为:c(Na+)>c(A-) |
| c(H+)c(A-) |
| c(HA) |
| 10-3×10-3 |
| 0.1 |


科目:高中化学 来源: 题型:
| A、A中存在A1O2- |
| B、A中c(C1-)>c(K+) |
| C、A的pH>7 |
| D、固体由NH4Cl、KOH、AgNO3 组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
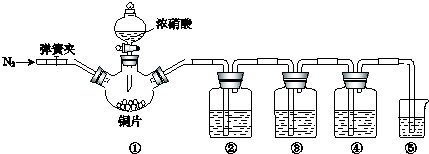
| 实验过程 | 实验现象 |
| Ⅰ.检验装置的气密性 | \ |
| Ⅱ.… | \ |
| Ⅲ.打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | ①中产生大量的红棕色气体,红棕色气体在②中变为无色,气体通过③后依然为无色,通过④后变为红棕色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 操作 | 现象 | 结论 |
| 假设一不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
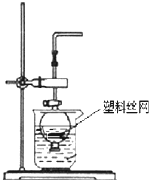 用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示.能用此装置制备的气体有( )
用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示.能用此装置制备的气体有( )| A、用块状大理石与稀硫酸反应制取CO2 |
| B、用锌粒与稀硫酸反应制取H2 |
| C、用过氧化钠与水反应制取O2 |
| D、用二氧化锰与浓盐酸反应制取Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=b>c>d |
| B、b>a=d>c |
| C、a=b>d>c |
| D、c>a=d>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com