
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:单选题
有一瓶无色气体,可能含有HCl、H2S、CO2、HBr、SO2中的一种或几种,将其通入氯水中得无色透明溶液,把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀,以下结论正确的是……( )
①原气体中肯定有SO2,②原气体中可能有SO2,③原气体中肯定没有H2S、HBr,④不能肯定原气体中是否含有HCl,⑤原气体中肯定无CO2,⑥原气体中肯定有HCl.
| A.①③④ | B.②④ | C.①③⑥ | D.①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
可以将六种无色液体:C2H5OH、AgNO3溶液,C2H5Br、KI溶液,C6H5OH溶液,C6H6区分开的试剂是
| A.FeCl3溶液 | B.稀硫酸 |
| C.酸性高锰酸钾溶液 | D.NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
NaNO3是重要的化工原料,可通过下列方法制备:
第一步:在吸收塔中,将硝酸生产中排出的尾气(体积分数:含0.5%NO、1.5%NO2)
用纯碱溶液完全吸收。
第二步:将吸收塔中的混合液送入转化塔中,加入50%HNO3溶液,同时通入足量的压缩空气搅拌,充分反应,得到NaNO3和硝酸的混合液。
第三步:将转化塔中的混合液用纯碱中和后,经蒸发浓缩、冷却结晶、离心分离、干燥,得NaNO3成品。
已知:每生产1.0t纯净的NaNO3固体,需消耗0.65 t无水Na2CO3、消耗氧气的体积为33.6 m3(标准状况下)和一定量的HNO3。生产过程中排出的尾气中均不含氮氧化物。
回答下列问题:
(1) 第一步生产过程中发生反应的总化学方程式是 。
(2) 检验NaNO3成品中是否含少量的Na2CO3杂质的方法是
(3) 生产过程中Na2CO3的利用率是________(计算结果精确到小数点后两位)。
(4) 生产1.0 t纯净的NaNO3固体,可以处理硝酸生产中排出的尾气的体积为多少m3(标准状况下)。请写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分) Mg(ClO3)2常用作催熟剂、除草剂等,下图为制备少量Mg(ClO3)2·6H2O的方法: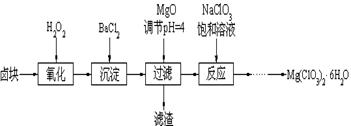
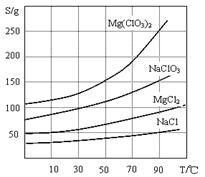
已知:1、卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
2、几种化合物的溶解度(S)随温度(T)变化曲线如上图。
(1)加入BaCl2的目的是除_________,如何判断该离子已除尽_____________________。
(2)加入NaClO3饱和溶液会发生反应:MgCl2+2NaClO3==Mg(ClO3)2+2NaCl↓,请利用该反应,结合溶解度图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应;②蒸发浓缩;③ ;④冷却结晶;
⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL配好的溶液于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/L K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:
Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
(3)写出步骤2中所发生反应的离子方程式 。
(4)步骤3中若滴定前用标准液润洗滴定管,会导致最终结果 (填“偏大”、“偏小”或“不变”)。
(5)产品中Mg(ClO3) 2·6H2O的质量分数为 (计算结果保留两位小数) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
莫尔盐【硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O】是一种重要化学试剂,实验室用含油污的铁片来制取莫尔盐,流程如下: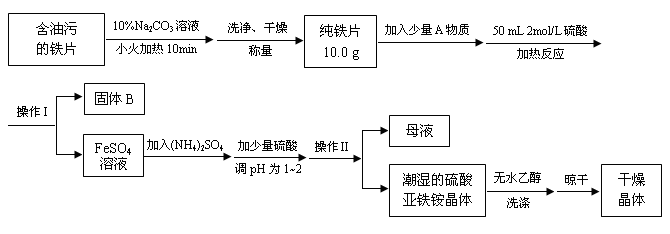
请回答下列问题:
(1)加入10%Na2CO3溶液的原因是___________________(用离子方程式表示)。
(2)A物质可以为________(填编号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
(3)B物质的成分为_________________。
(4) 加少量硫酸调节pH为 1~2的目的是_____________________________,
操作Ⅱ的名称_______________________________________________。
(5)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是_________________________________________。
(6)鉴定所得晶体中含有Fe2+、NH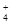 、SO
、SO 离子的实验方法正确的是________(填编号)。
离子的实验方法正确的是________(填编号)。
a.取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入酸性KMnO4溶液,观察现象
c.取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
V2O5是接触法制硫酸的重要催化剂,工业上生产V2O5的工艺流程如下:请回答下列问题: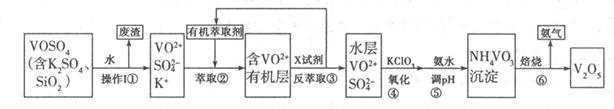
(1)步骤①所得废渣的成分是 (写化学式),它与NaOH溶液反应的离子反应方程式为 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层) 2RAn(有机层)+nH2SO4(水层),
2RAn(有机层)+nH2SO4(水层),
①实验室中步骤②、③使用的主要仪器是 。
②中萃取时必须加入适量碱,其原因是 。
(3)步骤③中X试剂为 ,步骤④的目的是 ,步骤⑤的离子方程式为 。
(4)该工艺流程中,可以循环利用的物质有 和 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一无色透明溶液,欲确定是否含有下列离子: Fe2+、Mg2+、Al3+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液进行实验:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊试液 | 溶液变红 |
| (2)取少量该溶液加热,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有白色沉淀,且不溶于稀HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀,NaOH过量时沉淀部分溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com