
| A. | 加入少量Na2CO3固体,平衡①右移,平衡②左移,溶液中c(F-)增大 | |
| B. | 加入少量NaOH固体至c(F-)>c(HF),溶液一定呈碱性 | |
| C. | 加入少量Na至pH=8,则C(Na+)-c(F-)=0.99×10-7mol•L-1 | |
| D. | 加入少量盐酸,$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$不变 |
分析 A.加入少量Na2CO3固体,会消耗H+;
B.等浓度的HF和NaF溶液中,HF的电离程度大于F-的水解程度,溶液显酸性;
C.根据电荷守恒分析;
D.$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$为常数,只与温度有关.
解答 解:A.加入少量Na2CO3固体,会消耗H+,则HF?F-+H+的电离平衡右移,F-的浓度增大,所以F-+H2O?HF+OH-左移,故A正确;
B.等浓度的HF和NaF溶液中,HF的电离程度大于F-的水解程度,溶液显酸性,c(F-)>c(HF),所以溶液不一定呈碱性,故B错误;
C.加入少量Na至pH=8,溶液转化电荷守恒为c(F-)+c(OH-)=c(H+)+c(Na+),则c(Na+)-c(F-)=c(OH-)-c(H+)=0.99×10-7mol•L-1,故C正确;
D.$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$为常数,只与温度有关,所以加入少量盐酸$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$不变,故D正确.
故选B.
点评 本题考查电解质溶液,涉及弱电解质的电离和盐类的水解、三大守恒关系的应用,把握平衡分析和溶液中离子浓度关系判断是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积/mL | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 26.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何条件下,反应2CO2(g)═2CO(g)+O2(g)均不能自发进行 | |
| B. | 依据反应I2+2S2O32-═2I-+S4O62-,若要测定平衡体系I2+I-?I3-中平衡时的 c(I2),可用已知物质的量浓度的Na2S2O3溶液进行滴定实验 | |
| C. | 向含有苯酚的苯溶液中滴入少量浓溴水未见白色沉淀,是因为生成的三溴苯酚又溶于苯中 | |
| D. | 检验某物质是否含有Fe2O3的操作步骤是:样品粉碎→加水溶解→过滤,向滤液中滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
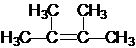 名称为2,3-二甲基-2-丁烯
名称为2,3-二甲基-2-丁烯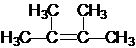 →
→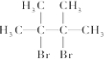
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 配制1.0mol/L CuSO4溶液 | 把25g胆矾晶体溶于水配成100mL溶液 |
| B | 证明某溶液中含有SO42- | 向该溶液中滴入BaCl2溶液 |
| C | 实验室制大量CO2 | 向稀硫酸中加入大理石 |
| D | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到热NaOH溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | 90℃ | 100℃ |
| 水的离子积常数 | 1×10-14 | 3.8×10-13 | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 微粒组 | 所加试剂 | 离子方程式 |
| A | NH4+、Mg2+、SO42- | 少量Ba(OH)2溶液 | NH4++SO42-+Ba2++OH-=BaSO4↓+NH3•H2O |
| B | Mg2+、HCO3-、Cl- | 过量NaOH溶液 | Mg2++2HCO3-+2OH-=MgCO3-↓+CO32-+2H2O |
| C | H+、Na+、NO3- | Fe粉 | Fe+2H+=Fe2++H2↑ |
| D | Ca2+、NH3•H2O、Cl- | 通入过量CO2 | NH3•H2O+CO2=NH4++HCO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑦ | B. | 除⑤⑥外 | C. | ②③⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com