
【题目】已知C3H8的燃烧热(△H)为-2219.9kJ/mol,且C3H8和H2O的汽化热分别为18.8KJ/mol、44.0kJ/mol。(汽化热是指在一定温度下,1mol物质由液态变成气态的过程中所吸收的热量。)
(1)试计算8.8g以液化石油气存在的C3H8在氧气中完全燃烧生成水蒸气时放出的热量为____________。
(2)在体积可变的密闭容器中投入1molCO和2molH2,在不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强変化如图1所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强変化如图1所示。
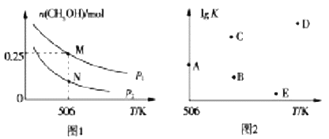
①M点时,H2的转化率为_________;压强:p1________p2(填“>”“<”或“=’’)
②反应速率:N点v正(CO)_________M点v逆(CO) (填“>”“<”或“=’’)
③若压强为p1、在1L恒容密闭容器中进行上述反应(应始投料不变,在不同温度下上述反应的平衡常数的对数(lgK)如图2所示。则温度为506K时,平衡常数K=________(保留三位小数),B、C、D、E四点中能正确表示该反应的lgK与T的关系的点为________。
④某温度下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)![]() CH3OH(g),达到平衡时,测得CO、H2、CH3OH分别为lmol、lmol、lmol,容器的体积为3L,该温度下,现往容器中继续通入3molCO,此时v(正)________v(逆)(选填“>”“<”或“=’’),用数据说明理由___________________。
CH3OH(g),达到平衡时,测得CO、H2、CH3OH分别为lmol、lmol、lmol,容器的体积为3L,该温度下,现往容器中继续通入3molCO,此时v(正)________v(逆)(选填“>”“<”或“=’’),用数据说明理由___________________。
(3)以二甲醚(CH3OCH3)为燃料、氧气为氧化剂、KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性材料)。
①若KOH溶液足量,则负极的电极反应式为____________。
②若电解质溶液中KOH的物质的量为0.2mol,当有0.1mol二甲醚参加反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是______________________。
【答案】 405.02kJ 25% > < 0.148L2·mol-2 BE = Qc=K=9,平衡不移动 CH3OCH3+16OH--12e-=2CO32-+11H2O c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)
【解析】(1)根据C3H8的燃烧热可得反应的热化学方程式为C3H8(l)+5O2(g)![]() 3CO2(g)+4H2O(l) ΔH=-2219.9kJ/mol,且C3H8与H2O的汽化热分别为18.8kJ/mol和44kJ/mol,根据反应的方程式可知气体C3H8发生反应时,生成气态H2O时放出的热量为-2219.9kJ/mol+18.8kJ/mol+4×44kJ/mol=-2025.1kJ/mol,8.8g液化石油气中含C3H8的物质的量为0.2mol,则释放的热量为0.2mol×2025.1kJ/mol=405.02kJ;正确答案:405.02kJ。
3CO2(g)+4H2O(l) ΔH=-2219.9kJ/mol,且C3H8与H2O的汽化热分别为18.8kJ/mol和44kJ/mol,根据反应的方程式可知气体C3H8发生反应时,生成气态H2O时放出的热量为-2219.9kJ/mol+18.8kJ/mol+4×44kJ/mol=-2025.1kJ/mol,8.8g液化石油气中含C3H8的物质的量为0.2mol,则释放的热量为0.2mol×2025.1kJ/mol=405.02kJ;正确答案:405.02kJ。
(2) ①M点时,生成的CH3OH为0.25 mol,消耗H2的物质的量为0.25mol×2=0.50 mol,则H2的转化率α(H2)=0.5/2×100%=25%;此反应的正反应是气体分子数减小的反应,增大压强,平衡向正反应方向移动。由题图1知,在相同温度下p2到p1,CH3OH的物质的量增大,说明平衡向正反应方向移动,即p1>p2;正确答案:25%;>。
②M、N点对应的温度相同,但M点对应的压强较大,反应速率较大;N点v正(CO)<M点v逆(CO);正确答案:<。
③506 K时, CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始(mol·L-1) 1 2 0
转化(mol·L-1) 0.25 0.50 0.25
平衡(mol·L-1) 0.75 1.50 0.25
K=![]() =
=![]() L2·mol-2≈0.148 L2·mol-2。K越大,lgK越大,该反应的正反应是放热反应,升高温度,平衡常数K减小,所以,B、E点符合题意;正确答案:0.148L2·mol-2 ;BE。
L2·mol-2≈0.148 L2·mol-2。K越大,lgK越大,该反应的正反应是放热反应,升高温度,平衡常数K减小,所以,B、E点符合题意;正确答案:0.148L2·mol-2 ;BE。
④达到平衡时,测得CO、H2、CH3OH分别为lmol、lmol、lmol,容器的体积为3L,则三种物质的浓度为c(CO)=c(H2)=c(CH3OH)=1/3mol/L, K=1/3/(1/3)2×1/3=9;该温度下,现往容器中继续通入3molCO,根据体积比和物质的量成正比可知,6mol混合气体的体积为6L,所以三种物质的浓度分别为c(CO)=4/6 mol/L=2/3 mol/L, c(H2)=1/6 mol/L, c(CH3OH)= 1/6 mol/L,该反应的浓度商Qc=1/6/(1/6)2×2/3=9=K,平衡不移动,此时v(正)=v(逆);正确答案:= ;Qc=K=9,平衡不移动。
(3)①二甲醚(CH3OCH3)为燃料电池,二甲醚做负极,失电子发生氧化反应,生成二氧化碳,在KOH溶液足量的情况下,最终生成碳酸钠溶液,则负极的电极反应式为: CH3OCH3+16OH--12e-=2CO32-+11H2O;正确答案:CH3OCH3+16OH--12e-=2CO32-+11H2O。
②根据碳原子守恒规律,当有0.1mol二甲醚参加反应时,生成CO2为0.2mol,0.2molCO2与0.2mol的KOH恰好完全反应生成碳酸氢钾溶液,水解过程大于电离过程,溶液显碱性,因此溶液中各种离子的物质的量浓度由大到小的顺序是:c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);正确答案:c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。


科目:高中化学 来源: 题型:
【题目】用如图所示装置探究铁粉在高温下与水蒸气反应的实验。
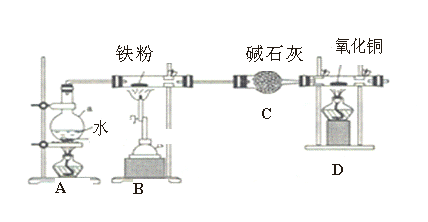
(1)A装置加热作用是___________________________;
(2)B中反应的化学方程式:_________________________________________,标准状况下,若该反应生成22.4L气体,则反应转移的电子数为______________。
(3)装置D中的现象是___________________,写出D中反应方程式:_________________。
(4)A 、B两处酒精灯点燃顺序:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草图经》中关于绿矾的分解有如下描述:“绿矾形似朴消(Na2SO4·10H2O)而绿色,取此物置于铁板上,聚炭,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金汁者是真也。”对此段话的说明中肯定错误的是( )
A. 绿矾的化学式为FeSO4·7H2O B. 绿矾分解过程中没有发生电子的转移
C. “色赤”物质可能是Fe2O3 D. 流出的液体中可能含有硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO、NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)与氮氧化物有关的全球或区域性大气环境问题有_______(填字母序号)。
a.酸雨 b.沙尘暴 c.光化学烟雾 d.白色污染
(2)NO2可与水发生反应,反应的化学方程式为__________________。若该反应有0.6NA个电子转移,则参加反应的NO2的物质的量为___________。
(3)NH3也是重要的含氮化合物,请写出实验室中由固体物质制取氨气的化学方程式________________________________;工业上可利用NH3经过一系列反应制取硝酸,请写出NH3在催化剂的作用下,与O2反应的化学方程式_________________________________。
(4)硝酸可与不活泼金属铜发生反应。将过量的铜置入一定量的浓硝酸中,微热,充分反应后,放出1.12 L气体(标准状况下),
①写出反应过程其中1个化学反应的化学方程式:_______________________________。
②整个反应过程中,被还原的HNO3总的物质的量是___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、目前世界上60%的镁是从海水中提取的。海水提镁的主要流程如下:
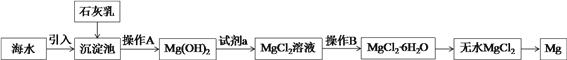
操作A是____________,下列仪器中操作B必须使用的有__________(填字母符号)。
A、锥形瓶 B、玻璃棒 C、表面皿 D、蒸发皿 E、坩埚
Ⅱ、乙醇镁[(CH3CH2O)2Mg] 为白色固体,难溶于乙醚和烃类,略溶于乙醇,在空气中会水解,常用作烯烃聚合催化剂载体和制备精密陶瓷的原料。某小组同学用镁粉(受潮会发生自燃、自爆)与乙醇在实验室中制备乙醇镁:
(1)干燥管中盛装的试剂为_____________,其作用为__________________________。
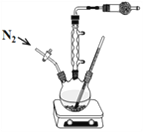
(2)下列操作的合理顺序为:______________。
a、将干燥的氮气通入装置,连续操作数次;
b、称取镁粉,量取无水乙醇加入反应器内;
c、加热回流,控制温度在80℃,反应1小时;
d、开启冷凝水和磁力搅拌器。
(3)将温度控制在80℃的原因是________________,写出生成乙醇镁的化学方程式____________________________。
(4)请你设计实验证明有乙醇镁生成(简述实验的方法):_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,卤化银(AgX,X=Cl,Br)的2条溶解平衡曲线如图所示,已知AgCl,AgBr的Ksp依次减小,且p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是
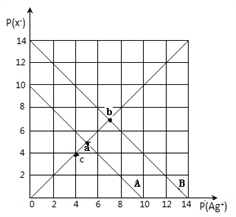
A. t℃时,c点可表示AgCl的不饱和溶液
B. B线表示的是AgBr
C. 取a、b两点处溶液等体积混合,维持t℃不变,混合溶液中一定无白色沉淀生成
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈104
AgBr(s)+Cl-(aq)平衡常数K≈104
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的氧化物、卤化物以及硫酸盐均为重要化合物。
(1)氧化铁为红棕色粉末,该物质难溶于水,易溶于盐酸中,请写出该物质与盐酸反应的离子方程式______________________________。
(2)铁在氯气中剧烈燃烧,产生红棕色的烟,将燃烧所得的三氯化铁溶于水,所得溶液的质量分数为16.25%,其密度为6.0g· mL-1,则该溶液中氯离子的物质的量浓度为________________;将上述所配制的溶液稀释为0.15mol/L 的稀溶液480mL,需要的仪器除烧杯、玻璃棒、量筒、胶头滴管之外,还需要________________;量取该溶液的体积是_______________mL;在配制过程中如果定容时俯视刻度线,会造成所配溶液浓度________(填“偏高”、“偏低”或“无影响”)。
(3)将饱和FeCl3溶液滴入沸腾的蒸馏水中,可以制得Fe(OH)3胶体,请写出该过程的化学反应方程式_______________________,以下关丁Fe(OH)3胶体的说法中不正确的有_____________(填序号。
A. Fe(OH)3胶体是一种红褐色、澄清、透明的混合物
B. Fe(OH)3胶体中分散质的微粒直径在10-9m~10-7m 之间
C.用渗析法鉴别Fe(OH)3胶体和FeCl3 溶液,用丁达尔效应分离Fe(OH)3胶体和FeCl3 溶液
D.取少量Fe(OH)3胶体置于试管中,向试管中逐滴滴加稀硫酸,可看到先产生红褐色沉淀,随后沉淀溶解,最终得到黄色的溶液
E.将其装入U 形管内,用石墨作电极,接通直流电,通电一段时间后发现靠近正极区附近的颜色逐渐变深
(4)在硫酸铁溶液中,逐滴加入等浓度的氢氧化钡溶液,其溶液的导电性随氢氧化钡溶液体积增加而变化的图象是(_______)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________、______________,制得等量H2所需能量较少的是_____________(填“系统(Ⅰ)”或“系统(Ⅱ)”)。
(2)羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 k时,将1 mol CO2与1 mol H2S充入2 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g) +H2O(g)。在610 k时,将1 mol CO2与1 mol H2S充入2 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率![]() =_______%,反应平衡常数K=________。
=_______%,反应平衡常数K=________。
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率![]() _____
_____![]() ,该反应的
,该反应的![]() H_____0。(填“>”“<”或“=”)
H_____0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)
A.N2 B.H2S C.COS D.CO2
(3)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c( H2S ) + c( HS- )=_____mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=______时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13 ]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com