
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等. 已知①Fe2O3(s)+3C(石墨,s)=2Fe(s)+3CO(g)△H1=+489.0kJmol﹣1
②C(石墨,s)+CO2(g)=2CO(g)△H2=+172.5kJmol﹣1
则CO气体还原Fe2O3(s)的热化学方程式为 .
(2)将CO2转化为甲醇的热化学方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0.850℃时, 该反应的平衡常数K=1.
①该反应的平衡常数表达式为 .
②若反应的容器容积为2.0L,反应进行4.0min时,容器内气体的物质的量减少了0,8mol,这段时间内υ(CO2)= .
③850℃时,若向1.0L的密闭容器中同时充入3.0molCO2(g)、1.0mol H2(g)、1.0mol CH3OH(g)和
5.0mol H2O(g),上述反应向(填“正反应”或“逆反应”)方向进行.
④若上述反应的平衡常数K值增大,该反应(填序号).
a.一定下正反应方向移动 b.一定下逆反应方向移动
c.在平衡移动过程中正反应速率先增大后减小 d.在平衡移动过程中逆反应速率先减小后增大.
【答案】
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣28.5 kJ?mol﹣1
(2)k= ![]() ;0.05mol?L﹣1?min﹣1;逆反应; ad
;0.05mol?L﹣1?min﹣1;逆反应; ad
【解析】解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol﹣1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol﹣1
依据盖斯定律①﹣②×3得到热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣28.5 kJmol﹣1,
所以答案是:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣28.5 kJmol﹣1;(2)①据CO2(g)+3H2(g)CH3OH(g)+H2O(g)此方程式,故k= ![]() ;
;
所以答案是:k= ![]() ;
;
②CO2(g)+3H2(g)CH3OH(g)+H2O(g)~ | △v=2mol |
1 | 2 |
0.4 | 0.8 |
故△n(CO2)=0.4mol,υ(CO2)= ![]() =0.05 molL﹣1min﹣1,
=0.05 molL﹣1min﹣1,
所以答案是:0.05 molL﹣1min﹣1;
③此时浓度商Qc= ![]() =
= 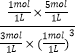 =
= ![]() ,故反应向逆反应进行,
,故反应向逆反应进行,
所以答案是:逆反应;
④平衡常数K值增大即平衡向正反应方向移动或者平衡移动过程中逆反应速率先减小后增大,
所以答案是:ad.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】CuCl是生产印刷颜料酞菁蓝的重要原料,工业上可用一种低品位铜矿(主要成分CuS、Cu2S、CuO、Fe2O3、FeO及其他非酸溶性杂质)和软锰矿(主要成分为MnO2和其他非酸溶性杂质)来进行生产,过程如下:

回答下列问题:
(1)步骤Ⅰ中反应较多,下列反应是其中之一:Cu2S+2MnO2+4H2SO4=2CuSO4+2MnSO4+4H2O+S,该反应的氧化产物为____________________(填化学式)。
(2)为确定滤液1中是否含有Fe2+,首先用有机萃取剂除去溶液中MnSO4,再取下层水溶液进行检测,所用试剂为_____________________。
(3)步骤Ⅱ加入氨水控制溶液的pH为5左右,目的是______________________。
(4)为模拟步骤Ⅲ的生产过程,某同学设计如下实验,下列有关叙述正确的是_____________。

A.a通入CO2,然后b通入NH3;c中放碱石灰
B.b通入NH3,然后a通入CO2;c中放碱石灰
C.a通入NH3,然后b通入CO2;c中放蘸稀硫酸的脱脂棉
D.b通入CO2,然后a通入NH3;c中放蘸稀硫酸|的脱脂棉
(5)步骤Ⅳ的滤液中主要成分X是步骤Ⅱ和步骤Ⅲ都有的产物,可以回收作为肥料使用,该肥料_______(填“可以”或“不可以”)与草木灰(有效成分K2CO3)共用,简述原因:__________。
(6)已知CuCl为难溶于水的白色沉淀,写出步骤Ⅴ发生反应的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用生活中或实验室中常用的物品,根据氧化还原反应知识和电化学知识,自己动手设计了一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+===Fe2++H2↑
(2)实验用品:电极(________、________)、稀硫酸、________、________、耳机(或者电流表)(填写所缺的实验用品)。
(3)实验装置如图。

(4)原电池设计及注意的问题:
①按如图所示装置连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发生“嚓嚓嚓……”的声音。其原因是在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量;
②如果将装置中的耳机改为电流表,则铁钉应该接电流表的______极,电极反应式为____,发生了______反应;
③铜钉应该接电流表的__________极,电极反应式为____________________________,发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
![]() +C2H5OH
+C2H5OH![]()
![]() +H2O
+H2O
已知:
颜色、状态 | 沸点(℃) | 密度(gcm﹣3) | |
苯甲酸* | 无色片状晶休 | 249 | 1.2659 |
苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
*苯甲酸在100℃会迅速升华.实验步骤如下:
①在圆底烧瓶中加入12.20g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按如图所示装好仪器,控制温度在6570℃加热回流2h.反应时环己烷一乙醇﹣水会形成“共沸物”(沸点62.6℃)蒸馏出来,再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇.
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞.继续加热,至分水器中收集到的液体不再明显增加,停止加热.
③将烧瓶内反应液倒人盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性.
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层.加入氯化钙,对粗产物进行蒸馏(装置如图所示),低温蒸出乙醚后,继续升温,接收210213℃的馏分.
⑤检验合格,测得产品体积为13.16mL.
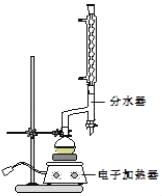
(1)在该实验中,圆底烧瓶的容积最适合的是_____(填入正确选项前的字母).
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中沸石的作用是____,使用分水器不断分离除去水的目的是_____.
(3)骤②中应控制馏分的温度在__.
A.215220℃ B.8590℃ C.7880℃ D.6570℃
(4)步骤③加入Na2CO3的作用是________;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是________.
(5)关于步骤④中的萃取分液操作叙述正确的是____.
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)cZ(g)△H 的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是 ( )
A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平 衡时,Z的物质的量分数不变
B.升高温度,正、逆反应速率都增大,平衡常数增大
C.△H>0,m+n>c
D.温度不变,增大压强,平衡正向移动,达新平衡时,A的浓度比原平衡减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com