
(16分)(1)写出下列物质在水溶液中电离的方程式
HNO3 HClO
NaHCO3
(2)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________。
(3)己知:①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+1/2O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
回答下列问题:
①上述反应中属于放热反应的是_________________。
②H2的燃烧热为_______________,C的燃烧热为__________________.
③燃烧l0gH2 生成液态水,放出的热量为_________________.
④CO的燃烧热为___________,其热化学方程式为_____________ __________.
(1)HNO3=H++NO3- HClO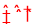 H++ClO- NaHCO3=Na++HCO3- HCO3-
H++ClO- NaHCO3=Na++HCO3- HCO3-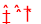 H++CO32-
H++CO32-
(2)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH= -725.76 kJ·mol-1 (3)①: ①②③④
②285.8 kJ·mol-1 393.5 kJ·mol-1 ③1429 kJ ④283 kJ·mol-1 CO(g)+1/2O2(g)=CO2(g) ΔH= -283 kJ·mol-1
【解析】
试题解析:(1)HNO3为强电解质,完全电离,电离方程式为HNO3=H++NO3- , HClO为一元弱酸不完全电离,电离方程式为HClO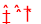 H++ClO-,NaHCO3为强电解质,完全电离,电离方程式为NaHCO3=Na++HCO3- HCO3-
H++ClO-,NaHCO3为强电解质,完全电离,电离方程式为NaHCO3=Na++HCO3- HCO3-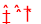 H++CO32-;(2)1g甲醇燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热22.68kJ×32=725.8KJ,燃烧热热化学方程式为:CH3OH(l)+
H++CO32-;(2)1g甲醇燃烧生成CO2和液态水时放热22.68kJ,1mol甲醇完全燃烧生成二氧化碳和液态水放热22.68kJ×32=725.8KJ,燃烧热热化学方程式为:CH3OH(l)+ O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ?mol-1,(3)①热化学方程式中△H为负值的反应为放热反应,△H为正值的为吸热反应,①H2(g)+
O2(g)═CO2(g)+2H2O(l)△H=-725.76 kJ?mol-1,(3)①热化学方程式中△H为负值的反应为放热反应,△H为正值的为吸热反应,①H2(g)+ O2(g)═H2O(l)△H=-285.8kJ/mol ②H2(g)+
O2(g)═H2O(l)△H=-285.8kJ/mol ②H2(g)+ O2(g)═H2O(g)△H=-241.8kJ/mol
O2(g)═H2O(g)△H=-241.8kJ/mol
③C(s)+ O2(g)═CO(g)△H=-110.5kJ/mol ④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
O2(g)═CO(g)△H=-110.5kJ/mol ④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
以上4个反应均为放热反应;②1mol纯净物完全燃烧生成稳定的氧化物所放出的热量为燃烧热,则H2的燃烧热为285.8 kJ·mol-1,C的燃烧热为393.5 kJ·mol-1 ;③烧l0gH2生成液态水,放出的热量为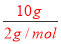 ×285.8 kJ·mol-1=1429 kJ;④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,把方程式④-③得:CO(g)+
×285.8 kJ·mol-1=1429 kJ;④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,把方程式④-③得:CO(g)+ O2(g)=CO2 (g)△H=-283.0kJ/mol,CO的燃烧热为283.0kJ/mol。
O2(g)=CO2 (g)△H=-283.0kJ/mol,CO的燃烧热为283.0kJ/mol。
考点:有关反应热的计算


科目:高中化学 来源:2014-2015学年浙江省高一上学期期中化学试卷(解析版) 题型:选择题
质量相同的氧气和二氧化碳中所含原子个数之比为
A.11:8 B.11:12 C.1:1 D.3:2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高一11月联考化学试卷(解析版) 题型:选择题
将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是
A.KSCN B.BaCl2 C.HCl D.NaOH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高一11月联考化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.钠与水反应 Na + H2O === Na+ + OH– + H2↑
B.AlCl3溶液中加过量氨水 Al3+ + 3OH– === Al(OH)3↓
C.向氯化亚铁中通入氯气 Fe2+ + Cl2=== Fe3+ + 2Cl–
D.铝粉投入到NaOH溶液2Al + 2OH– + 2H2O===2 AlO2– + 3H2↑
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高二11月联考化学试卷(解析版) 题型:填空题
(10分)在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g) 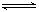 2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
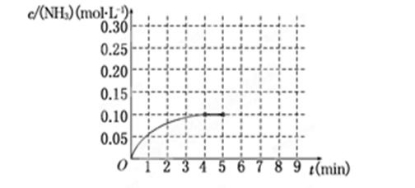
(1)根据上图,计算从反应开始到平衡时,平衡反应速率v(NH3)为__________.
(2)该反应达到平衡时H2的转化率为________.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________.(填序号)
a.0.20 mol·L-1 b.0.12 mol·L-1
c.0.10 mol·L-1 d.0.08 mol·L-1
(4)请写出该反应的平衡常数表达式___ ______,若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>”“=” 或 “<” )。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高二11月联考化学试卷(解析版) 题型:选择题
下列各组物质,前者为强电解质,后者为弱电解质的是
A.食盐、浓氨水 B.苛性钠、硫化氢
C.硫酸、硫酸钡 D.三氧化硫、二氧化硫
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高二11月联考化学试卷(解析版) 题型:选择题
向AgCl饱和溶液中加水,下列叙述正确的是
A.AgCl的溶解度增大
B.AgCl的溶解度、Ksp均不变
C.AgCl的Ksp增大
D.AgCl的溶解度、Ksp均增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高二上期期中化学试卷(解析版) 题型:填空题
(13分)下表是元素周期表的一部分,表中所列字母分别代表一种化学元素。请用元素符号等化学用语回答下列有关问题:
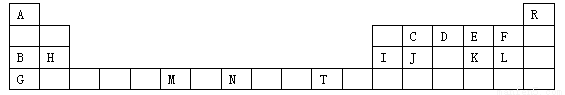
(1)上述元素中第一电离能最大的元素是 ,C、D、E、F四种元素第一电离能由大到小的顺序 。
(2)由A、C、D形成的ACD分子中,σ键个数∶π键个数=________。
(3)要证明太阳上是否含有R 元素,可采用的方法是 。
(4)能够说明K、F两元素非金属性强弱的事实是 ;若欲用一个简单实验证明H、I两种元素金属性的强弱,其实验方法是 。
(5)元素M的化合物(MO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。已知MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断MO2Cl2是_____(填“极性”或“非极性”)分子。
(6)C、D两种元素,C的气态氢化物难溶于水,而D的气态氢化物却极易溶于水,
其原因是 。
(7)在元素N的低价硫酸盐溶液中,加入少量由元素G、L、E组成的化合物(原子个数比为1:1:1),观察到的现象是 ;有关反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏育才中学高二上学期期中化学试卷(解析版) 题型:选择题
在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com