
 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.分析 (1)硒为34号元素,有6个价电子,据此书写价层电子排布式;
(2)同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素;同主族,从上到下,元素的第一电离逐渐减小;
(3)根据中心原子的价层电子对数可判断杂化方式及微粒的立体构型,等电子体是指价电子和原子数都相等的微粒;
(4)H2Se分子中有孤电子对,据此判断分子的极性;根据晶体的性质可判断晶体的类型;
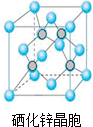
(5)根据硒化锌晶胞结构图可知,该晶胞中含有硒原子数为8×$\frac{1}{8}$+$6×\frac{1}{2}$=4,含有锌原子数为4,根据$ρ=\frac{m}{V}$可计算出晶胞的体积,进而确定晶胞的边长;
解答 解:(1)硒为34号元素,有6个价电子,所以硒的价层电子排布式为4s24p4,
故答案为:4s24p4;
(2)同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素,所以Ge、As、Se三种元素的第一电离能的大小顺序是:As>Se>Ge,
故答案为:As>Se>Ge;
(3)H2SeO3的中心原子的价层电子对数为$\frac{6+2}{2}$=4,所以Se杂化方式为sp3杂化,SeO32-的中心原子Se的价层电子对数为$\frac{6+2}{2}$=4,离子中有一个孤电子对,所以SeO32-的立体构型是 三角锥形,等电子体是指价电子和原子数都相等的微粒,与SeO42-互为等电体的分子有CCl4(或SiF4),
故答案为:sp3; 三角锥形;CCl4(或SiF4);
(4)H2Se分子中有孤电子对,所以H2Se属于 极性分子,单质硒的熔点为217℃,比较小,所以它属于分子晶体,
故答案为:极性;分子;
(5)根据硒化锌晶胞结构图可知,该晶胞中含有硒原子数为8×$\frac{1}{8}$+$6×\frac{1}{2}$=4,含有锌原子数为4,根据$ρ=\frac{m}{V}$=$\frac{\frac{4M}{N{\;}_{A}}}{V}$,所以V=$\frac{4M}{ρN{\;}_{A}}$,则晶胞的边长为$\root{3}{\frac{4M}{ρN{\;}_{A}}}$cm=$\root{3}{\frac{4M}{ρN{\;}_{A}}}$×1010pm,
故答案为:$\root{3}{\frac{4M}{ρN{\;}_{A}}}$×1010.
点评 本题考查了价电子排布、原子轨道的杂化、等电子体、分子的极性、分子的空间构型、晶胞的计算等知识,注意把握微粒空间构型的判断方法,侧重对学生综合能力的考查,题目难度中等.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:推断题
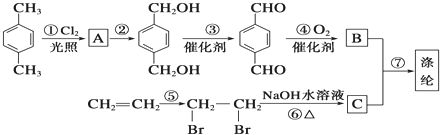
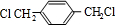 ,B
,B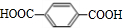 ,CHOCH2CH2OH.
,CHOCH2CH2OH. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实 验 操 作 | 实验目的或结论 |
| A | 向某溶液中加入几滴氯水后再滴入KSCN溶液,溶液变红 | 该溶液中一定含Fe2+ |
| B | 将吸有NaOH溶液的长胶头滴管伸入盛有FeSO4溶液的试管底部并缓慢挤出碱液 | 防止加碱过程中带入空气,制备并较长时间观察到白色絮状的Fe(OH)2沉淀 |
| C | 蒸馏实验操作时将温度计插入液面以下但不能触碰到烧瓶内壁 | 准确测定馏分的温度,以便于液体混合物分离 |
| D | Fe(OH)3胶体的电泳实验中发现阴极附近颜色加深而阳极附近颜色变浅 | 说明Fe(OH)3胶体带正电荷 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合碳酸氢钙与氢氧化钠溶液 | B. | 混合硫酸铝与氢氧化钠溶液 | ||
| C. | 混合浓氨水和硫酸铝溶液 | D. | 混合盐酸和硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
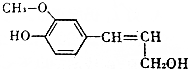 木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法正确的是( )
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法正确的是( )| A. | 该物质的分子式是C10H15O3,属于芳香族化合物 | |
| B. | 1mol该物质最多能与1molH2发生加成反应 | |
| C. | 1mol该物质只能与1molBr2反应 | |
| D. | 该物质可以与FeCl3溶液发生显色反应,也能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| Ⅰ | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com