
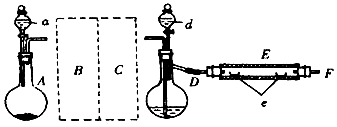

| 操 作 | 现 象 |
| 取0.1mol/L的FeBr2溶液100mL,测溶液的pH | pH试纸变红(约为4) |
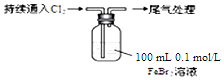 | ⅰ.开始通入100mLCl2(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
分析 (1)根据仪器的特征以及常见仪器的名称解答,溴的沸点:58.78℃,“水浴法”加热可以受热均匀,可用水浴的方法加热得到溴蒸气;
(2)实验室用碳酸钙和盐酸制取二氧化碳,氯化氢易挥发,装置B用于除去二氧化碳中的氯化氢气体;装置C作用是干燥二氧化碳;溴蒸汽有毒,不能排到空气中,可以用碱液如氢氧化钠溶液吸收未反应的溴单质;
(3)根据溴能够腐蚀橡胶塞分析;
(4)通入二氧化碳,可以将容器中的空气赶净,将Br2蒸气带入反应器D中;
(5)原因①:Fe2+被C12氧化成Fe3+,向该溶液中加入KSCN溶液,溶液变为红色证明有三价铁生成;
原因②:Br-被C12氧化成Br2溶解在溶液中,通过溶液中加入适量四氯化碳,萃取出溴单质从而使CCl4层呈橙红色来证明有溴单质生成;
(6)氧化性Cl2>Br2>Fe3+,亚铁离子的还原性大于溴离子,氯气不足时亚铁离子优先反应,0.1mol/L的FeBr2溶液100mL,通入224mL Cl2(标准状况),二价铁离子全部被氧化,溴离子部分被氧化.
解答 解:(1)仪器D具有支管口的烧瓶,为蒸馏烧瓶,溴的沸点:58.78℃,给D加热得到溴蒸气,酒精灯加热,温度不便于控制,油浴,油的比热容小,升温快,会导致蒸馏瓶中的液体迅速沸腾,不易控制温度,溴的沸点低于水的沸点100℃,用水浴加热,使反应容器内溴受热温度均匀,均匀产生溴蒸汽,所以b符合,
故答案为:蒸馏烧瓶;b;
(2)实验室用碳酸钙和盐酸制取二氧化碳,氯化氢易挥发,装置B用于除去二氧化碳中的氯化氢气体,可以用盛有NaHCO3饱和溶液的洗气瓶洗气,装置C作用是干燥二氧化碳,可以用盛有浓H2SO4的洗气瓶干燥,溴蒸汽有毒,不能排到空气中,可被碱液吸收,如氢氧化钠溶液能够与溴单质反应,适宜为防止污染空气,实验时应在F处连接盛有碱液如氢氧化钠溶液的尾气吸收装置,
故答案为:盛有饱和NaHCO3溶液的洗气瓶;盛有浓H2SO4的洗气瓶;碱性;
(3)D和E中均盛有溴,溴单质能够腐蚀橡胶塞,适宜装置D和E的橡皮塞最好用锡箔包住,橡胶管尽可能短,
故答案为:Br2有腐蚀性,腐蚀橡胶塞;
(4)反应过程中要不断地通入CO2,其主要作用是为:反应前先通入一段时间CO2,将容器中的空气赶净,避免空气中的氧气干扰实验;反应过程中要不断通入CO2,还可以将Br2蒸气带入反应器D中,使溴能够与铁粉充分反应,
故答案为:①排净容器里的空气;②将Br2蒸气带入反应器中;
(5)原因①:Fe2+被C12氧化成Fe3+,向该溶液中加入KSCN溶液,溶液变为红色证明有三价铁生成;
原因②:Br-被C12氧化成Br2溶解在溶液中,通过溶液中加入适量四氯化碳,萃取出溴单质从而使CCl4层呈橙红色来证明有溴单质生成;
故答案为:取5mL上述黄色溶液于试管中,向该溶液中加入KSCN溶液,溶液变为红色,说明原因①对,否则不成立;
取5mL上述黄色溶液于试管中,向其中滴加少量四氯化碳,震荡,若CCl4层呈橙红色,说明原因②对,否则不成立;
(6)因还原性:Fe2+>Br-,氯气先氧化Fe2+,再氧化Br-,向0.1mol/L的FeBr2溶液100mL,FeBr2的物质的量为0.01mol,溶液中通入0.01molCl2,先发生Cl2+2Fe2+═2Fe3++2Cl-,后发生2Br-+Cl2=Br2+2Cl-,二价铁离子全部被氧化,溴离子部分被氧化,总离子方程式:2Cl2+2Br-+2Fe2+═2Fe3++4Cl-+Br2,
故答案为:2Cl2+2Br-+2Fe2+═2Fe3++4Cl-+Br2.
点评 本题考查了制取溴化亚铁方案设计,充分考查了学生的分析、理解能力及灵活应用化学知识的能力,(6)注意反应物用量对反应的影响,为易错点,题目难度中等.


科目:高中化学 来源: 题型:填空题
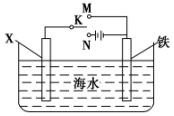 利用如图装置,可以模拟铁的电化学防护.
利用如图装置,可以模拟铁的电化学防护.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
(1)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂均为固体 | |
| B. | 油脂在体内直接氧化产生热量 | |
| C. | 多吃动物脂肪比多吃植物油有利 | |
| D. | 有些脂肪酸是人体必需的,但在人体内却不能合成;脂肪中必需脂肪酸的含量越高,其营养价值越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
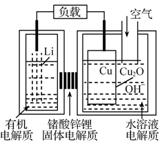 锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )
锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景.该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,其工作原理如图所示,下列说法不正确的是( )| A. | 电池放电时,正极附近溶液pH增大 | |
| B. | 工作时,Li+透过固体电解质向Cu极移动 | |
| C. | 电池放电过程中,空气中的O2并不参加反应 | |
| D. | 两极的有机电解质和水溶液电解质不可对换 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com