
(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+________+H2SO4—→________+________+________+________+H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则
①Br2的化学计量数是________;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
KBrO3+ ________+ H2SO4—→;
③若转移10 mol e-,则反应后生成I2的物质的量为________。
解析 (1)根据KBrO3在反应后Br元素的化合价降低,则其作氧化剂,则需填入还原剂KI,故所得的未配平的化学方程式为KBrO3+KI+H2SO4—→I2+Br2+K2SO4+KBr+H2O。
(2)①如果I2前是8,KBr前是1,则根据碘元素化合价变化知共失电子16 mol, KBr的系数是1,得电子为6 mol,则KBrO3→Br2共得电子10 mol,即Br2的系数为1;②由①中变化可知,KI的系数为16,KBrO3的系数为3,再根据K的原子数守恒推出K2SO4的系数为9,所以H2SO4的系数为9,即3KBrO3+16KI+9H2SO4===8I2+Br2+9K2SO4+KBr+9H2O;③若转移10 mol电子,则
16KI~16e-~8I2
10 y
解得y=5 mol。
答案 (1)KBrO3+KI+H2SO4—→I2+Br2+K2SO4+KBr+H2O
(2)①1
②3 16 KI 9
③5 mol


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
实验室欲配制一种仅含四种离子(不考虑来源于水电离的离子)的溶液,且溶液中四种离子的浓度均相等,能达到此目的的是( )
A.Na+、Mg2+、SO 、Cl-
、Cl-
B.ClO-、I-、NH 、Ba2+
、Ba2+
C.Na+、AlO 、K+、HCO
、K+、HCO
D.Al3+、K+、SO 、NO
、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
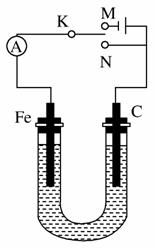
如图所示,用铁棒和石墨棒作电极电解1 L 1 mol/L的食盐水,下列有关说法正确的是( )
A.电键K与N连接,铁棒被保护而免受腐蚀
B.电键K与N连接,正极反应式为4OH--4e-===2H2O+O2↑
C.电键K与M连接,当两极共产生标准状况下气体33.6 L时,理论上生成1 mol NaOH
D.电键K与M连接,将石墨棒换成铜棒,就可实现在铁棒上镀铜
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
[已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7]

(金属离子含量与混合液pH、CuCl产率与混合液pH的关系图)
请回答下列问题:
(1)酸浸时发生反应的离子方程式是______________________;析出CuCl晶体时的最佳pH在____左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________________________________________________________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70 ℃干燥2小时、冷却,密封包装。70 ℃真空干燥、密封包装的目的是_____________________________________________________________。
(4)产品滤出时所得滤液的主要成分是________________,若想从滤液中获取FeSO4·7H2O晶体,我们还需要知道的是_____________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式________________________________________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式表达正确的是( )
A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
B.小苏打溶液呈碱性的原因:HCO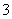 +H2OH3O++CO
+H2OH3O++CO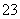
C.溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
D.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH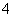 +Al3++2SO
+Al3++2SO +2Ba2++5OH-===AlO
+2Ba2++5OH-===AlO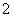 +2BaSO4↓+NH3·H2O+2H2O
+2BaSO4↓+NH3·H2O+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.乙醇和乙酸都是常用调味品的主要成分
B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高
C.乙醇和乙酸都能发生氧化反应
D.乙醇与乙酸反应生成乙酸乙酯,说明乙醇具有碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
观察下图中物质分子的比例模型及其变化,请回答下列问题:
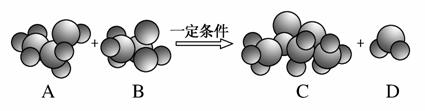
(1)A是乙醇,则B、C的结构简式分别为__________________、__________________。
(2)上图所示化学方程式中的“一定条件”是________________________________________________________________________。
(3)反应物中只有乙醇分子中的氧原子是18O,生成物中含这种氧原子的是(写物质名称)________。
(4)在B的分子中,最外层电子数为8的原子有________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
食盐是日常生活的必需品,也是重要的化工原料。粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO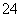 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
(1)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO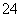 ,选出a所代表的试剂,按滴加顺序依次为____________(只填化学式)。
,选出a所代表的试剂,按滴加顺序依次为____________(只填化学式)。
(2)用于沉淀的试剂需过量,判断除去SO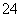 的试剂过量的方法是________________。
的试剂过量的方法是________________。
(3)洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为
________________________________________________________________________
________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于苯的叙述正确的是
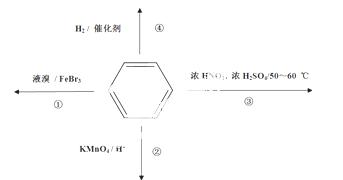
A.反应①常温下不能进行,需要加热
B.反应②不发生,但是仍有分层现象,紫色层在下层
C.反应③为加成反应,产物是一种烃的衍生物
D.反应④能发生,从而证明苯中是单双键交替结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com