
| A. | HCl | B. | NaOH | C. | Na2SO4 | D. | CuSO4 |
分析 A.电解盐酸时,是电解HCl本身,溶液中HCl浓度减小,酸性减弱;
B.电解氢氧化钠溶液实质是电解水,溶液中氢氧化钠溶液增大,碱性增强;
C.电解硫酸钠溶液实质是电解水,硫酸钠溶液呈中性,溶液pH不变;
D.电解CuSO4溶液生成铜和氧气以及硫酸,溶液酸性增强.
解答 解:A.电解HCl溶液即电解HCl本身,溶液中HCl浓度减小,酸性减弱,则溶液的pH增大,故A错误;
B.电解NaOH时生成氢气和氧气,实质是电解水,溶液中氢氧化钠溶液增大,碱性增强,溶液的PH升高,故B错误;
C.电解硫酸钠溶液实质是电解水,硫酸钠溶液呈中性,溶液pH不变,故C错误;
D.电解CuSO4时,生成铜和氧气以及硫酸,溶液的PH降低,酸性增强,溶液的pH减小,故D正确;
故选D.
点评 本题是对电解原理的考查,关键明确离子放电顺序,注意掌握常见电解类型,难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 操作 |
| A | 配制100mL1.0mol•L-1 CuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| B | 除去固体Na2CO3中的少量NaHCO3 | 将混合物加热充分反应 |
| C | 在溶液中将MnO4-完全转化为Mn2+ | 向酸性KMnO4溶液中通入SO2气体至紫色消失 |
| 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
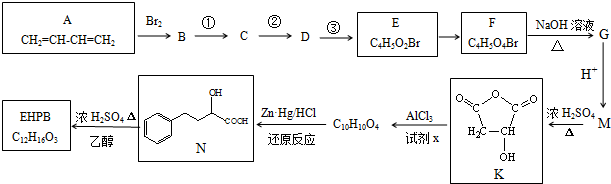
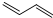 +Cl2$\stackrel{1,2-加成}{→}$
+Cl2$\stackrel{1,2-加成}{→}$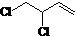 $\stackrel{1,4-加成}{→}$
$\stackrel{1,4-加成}{→}$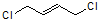
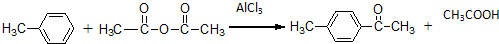
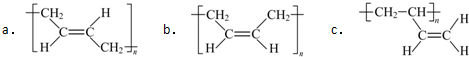
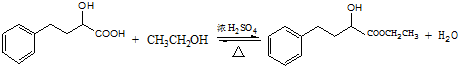 .
.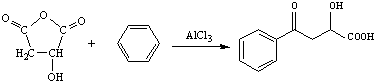 .
.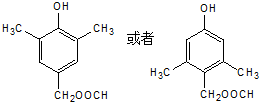 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铝是应用最广泛的两种金属.完成下列填空:
铁、铝是应用最广泛的两种金属.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应一定不需加热就可以进行 | |
| B. | 等物质的量的氢气完全燃烧生成气态水比生成液态水放热多 | |
| C. | 中和热测定时,用铁质材料代替环形玻璃搅拌器,所测中和热数值偏小 | |
| D. | S(g)+O2(g)═SO2 (g);△H1 S(s)+O2(g)═SO2 (g);△H2 △H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上海世博会很多场馆的外墙使用的非晶体薄膜,以充分利用天阳能,体现低碳经济 | |
| B. | 金属的电化学防护措施有牺牲阳极的阴极保护法和外加电流的阴极保护法 | |
| C. | 若在水果贮藏室中,放几块被KMnO4溶液浸透过的“砖块”,可延长水果保存时间 | |
| D. | 常温时,某可逆反应的平衡常数越大则其反应速率就越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖可通过酒化酶水解生成酒精 | |
| B. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| C. | 向植物油中加入酸性高锰酸钾紫色溶液,振荡后,酸性高锰酸钾溶液颜色褪去 | |
| D. | 淀粉溶液与稀硫酸溶液共热,再加入新制氢氧化铜悬浊液加热,无红色沉淀,则可证明淀粉没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
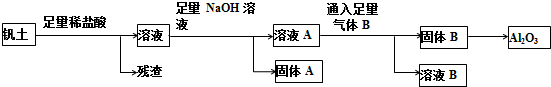
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com