
根据组成原电池的条件,试以反应:Fe+Cu2+=Fe2++Cu设计一个原电池,画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中),写出电极反应式。
供选用的电解质溶液有:稀硫酸、硫酸铜溶液、氯化铜溶液。
供选用的电极材料有:锌片、铜片、铁片、石墨。
电极材料及电极反应式:
负极材料: ,电极反应式:
正极材料: ,电极反应式:
电解质溶液: 。
Fe;Fe-2e—=Fe2+;石墨或铜片;Cu2++2e—=Cu;氯化铜或硫酸铜溶液
解析试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据方程式可知,铁失去电子,发生氧化反应,所以铁是负极,电极反应式是Fe-2e—=Fe2+。铜离子得到电子,因此电解质溶液是含有铜离子的可溶性铜盐。而正极材料可以是石墨或金属性弱于铁的铜等,正极电极反应式是Cu2++2e—=Cu。
考点:考查原电池构成条件的判断、电极反应式的书写等
点评:该题是高考中的常见考点,侧重对学生基础知识的巩固和训练。有利于培养学生的逻辑推理能力和规范答题能力。明确原电池的工作原理、构成条件是答题的关键,注意相关知识的积累和总结。


科目:高中化学 来源: 题型:填空题
课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图链接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附件先显红色。试回答下列问题:
(1)电源A极的名称是 。
(2)甲装置中电解反应的总化学方程式: 。
(3)如果收集乙装置中产生的气体,相同状况下两种气体的体积比是 。
(4)欲用丙装置给铜镀银,G应该是 (填“铜”或“银”),电镀液的溶质是 (填化学式)。
(5)装置丁中的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上生产氯气常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
(1)这种阳离子交换膜,只允许溶液中的 通过。(填下列微粒的编号)
①H2 ②Cl2 ③H+ ④Cl- ⑤Na+ ⑥OH-
(2)写出在电解过程中发生的电极方程式阳极: 。
(3)已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为 。
(4)某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
①写出在电解过程中发生的电极方程式
阴极: 。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为280(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请回答下列问题。
(1)该泉水属于 硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂加入时的先后次序是 ,原因是 。
(3)目前常用阴、阳离子交换树脂来进行硬水的软化,如水中的Ca2+、Mg2+可与交换树脂中的 交换。当阴离子交换树脂失效后可放入 溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。右边是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
①阳离子交换膜是指 (填A或B);
②写出通电后阳极区的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如下:
(1)操作Ⅱ的名称是____________。
(2)可循环利用的物质____________(填化学式)。
(3)反应②的产物中,氧化产物与还原产物的物质的量之比是______。
(4)反应②中“酸化”时不能选择下列酸中的______(填字母序号)
A.稀盐酸 B.稀硫酸 C.稀醋酸
(5)电解猛酸钾溶液也可以得到高锰酸钾,其阴极反应式为:2H2O+2e-=2OH-+H2↑,如下图,b作____________极,电解池的阳极反应式是____________;若电解过程中收集到2.24L H2(标准状况),则得到高锰酸 钾____________克。(提示:阴离子放电顺序MnO42->OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化工原料红矾钠(重铬酸钠:Na2Cr2O7?2H2O)主要是以铬铁矿(主要成份为FeO?Cr2O3,还含有A12O3、 SiO2等杂质)为主要原料生产,其主要工艺流程如下: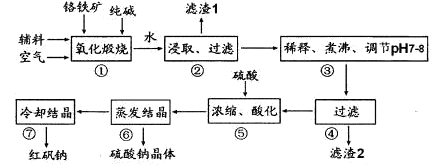
步骤①中主要反应的化学方程式为:4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。
(2)杂质A12O3、SiO2在①中转化的化学反应方程式为 。
(3)用化学平衡移动原理说明③中煮沸的作用是 (用离子方程式结合文字说明),若调节pH过低产生的影响是 。
(4)⑤中酸化是使CrO42一转化为Cr2O72一,写出该反应的离子方程式: 。
(5)工业上还可用电解法制备重铬酸钠,其装置示意图如下: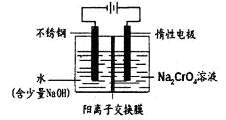
阴极发生的电极反应式为: 。
阳极发生的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为相互串联的甲乙两电解池
试回答:
(1)甲池若为用电解原理精炼铜的装置,则B是 极,材料是 ,A电极反应为 。
(2)乙池中若滴入少量石蕊试液,电解一段时间后Fe极附近呈 色.
(3)若甲池为电解精炼铜,阴极增重6.4g,则:乙池中阳极放出的气体在标准状况下的体积为 ;若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体单质,各物质有以下的转化关系(部分产物及条件略去)。
请回答以下问题:
(1)写出该原电池的总反应方程式_____________________。
(2)写出②的化学方程_________________。
(3)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为 。(写出计算式)
(4)若③中J的氧化物为磁性氧化物,且每生成1mol J放出Q kJ的热量,请写出A→J反应的热化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com