
����Ŀ���ڻ�ѧ�����У�������KMnO4����Һ������KMnO4�����������²�̫�ȶ����������ֱ������ȷ���ʵ���Ũ�ȵ�KMnO4��Һ��ʵ����һ���ȳ�ȡһ��������KMnO4���壬����ɴ���Ũ�ȵ�KMnO4��Һ�����������ȶ�����Է��������ϴ�Ļ����ʲ�����[ Na2C2O4 ��Է���������134.0 ]�Դ����KMnO4��Һ���б궨����������Ƶ�KMnO4��Һ��ȷŨ�ȣ���Ӧԭ��Ϊ�� 5C2O42����2MnO4����16H��===10CO2����2Mn2����8H2O�����DZ궨KMnO4��Һ��ʵ�鲽�裺
����һ���ȴ���Ũ��ԼΪ0.15mol/L��KMnO4��Һ500mL��
�������ȷ��ȡNa2C2O4����mg������ƿ�У�������ˮ�ܽⲢ��ϡ�����ữ��������70~80�����ò���һ����KMnO4��Һ���еζ�����¼������ݡ�
�������� ��
�����ģ������KMnO4��Һ�����ʵ���Ũ�ȡ�
�Իش��������⣺
��1������ͼΪ���������п���ʹ�õ������IJ��ֽṹ���е��������Ŵ�
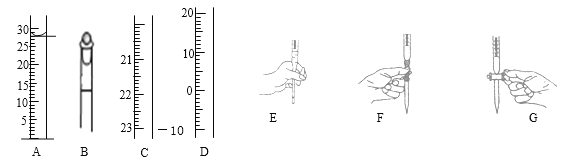
Aͼ��Һ����ʾ��Һ�����Ϊ mL�����������������е�ij�ֲ���ijҺ��������ƽ��ʱ����ΪNmL������ʱ����ΪMmL����M��N������ʹ�õ������� ������ĸ��ţ���
��2���õζ�ʵ��ζ��յ�������� ��
��3��������еζ�����ͼʾ������ͼ����ȷ���� �����ţ���
��4��������ĵζ������¶ȱ仯�������ԣ������������з���ǰһ����Һ��ɫ�������м����ɫ���Ա�죬������ɫ�ֱ������Ը���Ӱ�컯ѧ��Ӧ���ʵ�������������Һ��ɫ�м����Ա�죬����ֱ�����ԭ���� ��
��5������������IJ������� ��
��6����m����ֵΪ1.340g���ζ���KMnO4��Һƽ������Ϊ25.00mL����KMnO4��Һ��Ũ��Ϊ mol/L��
��7�����ζ���Ϻ����ʱ���ӣ���ʵ�����Ϊ ������ƫ��������ƫ����������Ӱ��������
���𰸡���1��28.0��C����2����Һ����ɫ��Ϊdz�Ϻ�ɫ���Ұ�����ڲ���ɫ����3��E����4���м����ɵ�Mn2+Ϊ������ʹ��Ӧ���ʱ�죻��Ӧ��Ũ�ȼ�С����Ӧ���ʱ�������5���ظ�������������Σ���6��0.1600����7��ƫ�ߡ�
�������������������1��AΪ��Ͳ����Һ���28.0mL�����Ӷ�����M>N��˵���������̶ȴ��ϵ�������C��ȷ��(2)�������һ�θ��������Һ����Һ����ɫ��Ϊdz�Ϻ�ɫ���Ұ�����ڲ���ɫ����3�����������Һ���������ԣ�Ӧ����ʽ�ζ���ʢ�ţ�����������Ӧ�����ֿ��ƻ�������E��ȷ��(4) �м����ɵ�Mn2+Ϊ������ʹ��Ӧ���ʱ�죻��Ӧ��Ũ�ȼ�С����Ӧ���ʱ�������5���ζ�ʵ�飬��Ҫ����2��3�Σ���˲��������ظ������2��3�Σ���������6��c(KMnO4)=1.340��2/(134��5��25��10��3)mol��L��1="0.1600" mol��L��1����7�����Ӷ��������ø��������Һ���ƫС�����ݣ�6��������������Һ��Ũ��ƫ�ߡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ�¶��£�ˮ�ﵽ����ƽ��ʱc(H+)��c(OH-)�Ĺ�ϵ��ͼ��ʾ������˵������ȷ����

A��100��ʱ��pH=12��NaOH��Һ��pH=2��H2SO4��Һ��������ʱǡ���кͣ�������Һ��pH����7
B��25��ʱ��0.2mol/L Ba(OH)2 ��Һ��0.2 mol/L HC1��Һ�������ϣ�������Һ��pH����7
C��25��ʱ��0.2 mol/L NaOH��Һ�� 0.2 mol/L����������Ϻ�ǡ���кͣ�������ҺpH����7
D��25��ʱ��pH=12�İ�ˮ��pH=2��H2SO4��Һ�������ϣ�������Һ��pHС��7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж�����A��B��C��D����Ԫ�أ����ǵ�ԭ��������������AԪ���γɵģ�2�������ӱȺ�ԭ�ӵĺ����������8����BԪ����AԪ�ؿ����һ�ֵ���ɫ����E��C�����������ȿ������ᷴӦ��Ҳ���ԺͼӦ��DԪ��ԭ�ӵ�M������7�����ӡ�
��1��CԪ�ص����� ________��D����̬�⻯����H2S��ȣ��ȶ��Խ�ǿ����_______���û�ѧʽ��ʾ����
��2��A��B��C��D����Ԫ���γɵļ����Ӱ뾶�ɴ�С��˳��Ϊ___________________���û�ѧʽ��ʾ����
��3��A�ij����⻯���������֣����к���18�����ӵķ��ӵĵ���ʽΪ��______________��
��4���õ���ʽ��ʾ������B2A���γɹ���__________________________��
��5����Ԫ����BԪ��λ��ͬһ���壬��Ԫ����AԪ�ؿ��γ�K2A��K2A2��KA2�ȶ��ֻ��������K2A2��KA2��CO2���ɷ�����Ӧ����Ӧ�뵭��ɫ����E��CO2�ķ�Ӧ���ƣ���д��K2A2��CO2������Ӧ�Ļ�ѧ����ʽ_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2 L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ��������ȷ����( )

A. ��Ӧ��ʼ��10 s����Z��ʾ�ķ�Ӧ����Ϊ0.158 mol/(L��s)
B. ��Ӧ��ʼ��10 s��X�����ʵ���Ũ�ȼ�����0.79 mol/L
C. ��Ӧ�Ļ�ѧ����ʽΪ��X(g)+Y(g)![]() 2Z(g)
2Z(g)
D. ��Ӧ���е�10 s�����÷�Ӧֹͣ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƽ�������ʾ�����������в��������ķϲ�����ĩ����SiO2��Fe2O3��CeO2��FeO�����ʣ���ij�����Դ˷�ĩΪԭ�ϣ�������¹������̶���Դ���л��գ��õ�Ce(OH)4��������泥�

��֪:
I.���������£�����ˮ��Һ����Ce3+��Ce4+������Ҫ������ʽ��
II. CeO2������ϡ��������л��ܼ��ɷ���ϡ��Ԫ����Ce�Ȼ����
�밴Ҫ��ش��������⣺
(1)Ce��ԭ������Ϊ58����λ��Ԫ�����ڱ��е�______���ڡ�
(2)����١���Ӧ�Ļ�ѧ����ʽ�ֱ�Ϊ_________________��______________��
(3)��������Bϴ�Ӹɾ��ķ�����____________________��
(4)����۵����ӷ���ʽΪ____________________��
(5)����X����Ϊ_________________��
(6)����ҺB�мӹ���������50 ��Cˮԡ�м��ȳ�ַ�Ӧ����ȹ��ˣ���Һ�����Թ��У������������Թܿڣ����á���ȴһ��ʱ����ռ��ò�Ʒ�̷���
������е�������Һ��ϡ�ᵼ��____________��������ȴһ��ʱ������Թ��й۲쵽��������______________________��
(7)ȡ2.08 g��ƷCe(OH)4�ӹ���ϡ�����ܽ����0.1000 mol/L FeSO4��Һ�ζ����յ㹲����90.00mL�����Ʒ��Ce(OH)4����������Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������һ���ܴ���������� ( )
A���ں��д���Al3+����ɫ��Һ�У�Cu2+��Na+��Cl-��SO42-
B���ں��д���H+ �� ��Һ�У�Na+��K+��CO32-��NO3-
C����ǿ�����Һ�У�NH4+��Na+��SO42-��Cl-
D���ڵμ�ʯ������ɫ����Һ�У�K+��Cu2+��Cl-��NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��R��X��Y��Z��ԭ�������������� a��b��c��d����4��Ԫ�صĵ��ʣ�a��b��c��d˳����R��X��Y��Z��Ӧ����aΪ�����г����Ľ����������г���a�����Ͻ�;ߺ����ߡ��ڼ���Һ��ͨ������壬������ɫ����������֮��ת����ϵ��ͼ��ʾ��
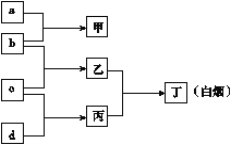
�ش��������⣺
��1��д��ZԪ����Ԫ�����ڱ��е�λ��______________________��
��2��д�����ʱ��ĵ���ʽ__________________��
��3��X��Y��ZԪ�ؼ����ӵİ뾶�ɴ�С���е�˳��Ϊ�������ӷ��ű�ʾ��______________��
��4��д��YԪ�ص�����������NaOH��Һ��Ӧ�����ӷ���ʽ______________________________��
��5��As���飩��X��ͬ��Ԫ�أ�λ�ڵ������ڣ���д����ԭ�ӵ�ԭ�ӽṹʾ��ͼ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�������Դ����������ȡ�봢��������Դ����������ȵ㡣
(1) NaBH4��һ����Ҫ�Ĵ������壬����ˮ��Ӧ����NaBO2���ҷ�Ӧǰ��B�Ļ��ϼ۲��䣬�÷�Ӧ�Ļ�ѧ����ʽΪ_________����Ӧ����1molNaBH4ʱת�Ƶĵ�����ĿΪ___________��
(2) H2S�ȷֽ������������Ӧ����ʽ��2H2S(g)=2H2(g)+S2(g) ��H���ں����ܱ������У����H2S�ֽ��ת����(H2S��ʼŨ�Ⱦ�Ϊc mol/L)��ͼ1��ʾ��ͼl������a��ʾH2S��ƽ��ת�������¶ȵĹ�ϵ������b��ʾ��ͬ�¶��·�Ӧ������ͬʱ����δ�ﵽ��ѧƽ��ʱH2S��ת���ʡ�

�١�H ______0(�>����<����=��)��
����985��ʱ����Ӧ��t min�ﵽƽ�⣬��ʱH2S��ת����Ϊ40%����t min�ڷ�Ӧ����v(H2)=_____���ú�c��t�Ĵ���ʽ��ʾ����
����˵�����¶����ߣ�����b������a�ӽ���ԭ��____________��
(3) ʹ��ʯ���ѽ�ĸ�����CH4����ȡH2��ij�¶��£������Ϊ2L���ܱ������г���0.40mol CH4(g)��0.60molH2O(g)��Ũ����ʱ��ı仯���±���ʾ��

��д���˷�Ӧ�Ļ�ѧ����ʽ_________�����¶��¸÷�Ӧ��ƽ�ⳣ����_________��
��3 minʱ�ı�ķ�Ӧ������_________��ֻ��һ�������ĸı䣩��
��һ��������CH4��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ����P1_________P2�>������<����=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ���������ֵ��������������ȷ���� ( )
A��1 mol NH3�����е�������Ϊ17NA
B�����³�ѹ�£�22.4 L����������ԭ����Ϊ2NA
C�����³�ѹ�£�48g O3��������ԭ����Ϊ3NA
D��1 mol/L NaCl��Һ��������Na+��ΪNA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com