
下列离子方程式正确的是( )
|
| A. | 常温下,将铁片置于过量的浓硝酸中:Fe+6H++3NO3﹣═Fe3++3NO2↑+3H2O |
|
| B. | 加热条件下,铜与浓硫酸反应:4H++SO42﹣+Cu |
|
| C. | 常温下,向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42﹣═BaSO4↓ |
|
| D. | 常温下,向稀硝酸中加入过量的铁片:3Fe+8H++2NO3﹣═3Fe2++2NO↑+4H2O |
考点:
离子方程式的书写.
专题:
离子反应专题.
分析:
A.常温下铁与浓硝酸发生钝化,阻止了反应的继续进行;
B.浓硫酸在离子方程式中不能拆开,应该保留分子式;
C.铵根离子能够与氢氧根离子反应生成一水合氨,该反应中漏掉了铵根离子与氢氧根离子的反应;
D.过量的铁与稀硝酸反应生成硝酸亚铁和一氧化氮气体.
解答:
解:A.常温下,将铁片置于过量的浓硝酸中,铁片发生了钝化现象,阻止了反应的继续进行,无法写出反应的离子方程式,故A错误;
B.铜与浓硫酸反应生成硫酸铜、二氧化硫和水,浓硫酸在离子方程式中不能拆开,正确的离子方程式为:2H2SO4(浓)+Cu Cu2++2H2O↑+SO42﹣+SO2↑,故B错误;
Cu2++2H2O↑+SO42﹣+SO2↑,故B错误;
C.常温下,向(NH4)2SO4溶液中加入适量Ba(OH)2,反应生成硫酸钡沉淀和弱电解质一水合氨,正确的离子方程式为:Ba2++2OH﹣+2NH4++SO42﹣═BaSO4↓+2NH3•H2O,故C错误;
D.铁过量,反应生成的是亚铁离子,反应的离子方程式为:3Fe+8H++2NO3﹣═3Fe2++2NO↑+4H2O,故D正确;
故选D.
点评:
本题考查了离子方程式的正误判断,该题是高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,选项C为易错点,注意不要漏掉铵根离子与氢氧根离子的反应.


科目:高中化学 来源: 题型:
单质与浓硝酸混合,出现的情况依次为:①反应生成相应的硝酸盐;②反应生成最高价含氧酸;③常温下单质发生钝化;④不发生反应.符合上述要求的单质组是( )
|
| A. | Cu、C、Zn、Au | B. | Si、P、Al、Pt | C. | Fe、C、Pt、Hg | D. | Cu、S、Fe、Au |
查看答案和解析>>
科目:高中化学 来源: 题型:
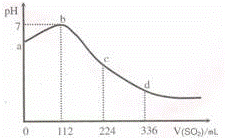
标准状况下,某同学向100mL H2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
|
| A. | 亚硫酸的酸性比氢硫酸的酸性弱 |
|
| B. | ab段反应是:SO2+2H2S═3S↓+2H2O |
|
| C. | 原H2S溶液的物质的量浓度为0.05mol/L |
|
| D. | b点对应的溶液导电性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
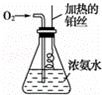
按如图所示的装置进行实验:
实验开始一段时间后,可观察到锥形瓶瓶口上方有白烟生成,请补充可能观察到的其他现象: .有关化学方程式为:① ;② ;③ ;④ .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验事实所作结论中,正确的是( )
| 实 验 事 实 | 结 论 | |
| A | A、B两种有机物具有相同的相对分子质量和不同的结构 | A、B互为同分异构体 |
| B | 质量相同的A、B两种有机物完全燃烧生成质量相同的水 | A、B两有机物最简式相同 |
| C | A、B两种有机物结构相似具有相同的通式 | A、B互为同系物 |
| D | 分子式为C6H6的烃A既能使溴的CCl4溶液褪色,又能使酸性KMnO4溶液褪色 | A的结构简式可能是 CH2═CH≡C﹣CH═CH2 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C是三种元素的原子,质子数都小于18.A原子与B原子的最外层电子数都是6,A原子与C原子的核外电子层数都为3,C原子的质子数比A少4.回答下列问题:
(1)A、B、C的元素符号分别为 、 、 .
(2)A的离子结构示意图为 ;A与C组成的化合物电子式为 .
(3)元素A的一种质量数为32的核素,与元素B的一种核素构成微粒为AB42﹣,1mol AB42﹣的质量为104g,则元素B的该核素中的中子数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com