
分析 H+、OH-结合生成水不能大量共存,则离子分为两组,溶液分别显碱性、酸性,根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,以此来解答.
解答 解:H+、OH-结合生成水不能大量共存,则离子分为两组,溶液分别显碱性、酸性,
CO32-、H+结合生成水和气体,不能大量共存;
OH-分别与NH4+、Fe3+反应不能共存,
两组的离子种类不重复,则第一组为H+、NH4+、Fe3+,第二组为SO42-、CO32-、OH-、Na+或(第一组为H+、NH4+、Fe3+、Na+,第二组为SO42-、CO32-、OH-)或(第一组为SO42-、H+、NH4+、Fe3+,第二组为CO32-、OH-、Na+),
故答案为:H+、NH4+、Fe3+;SO42-、CO32-、OH-、Na+.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 蜂蜜中含有的葡萄糖 | B. | 石油中含有的C16H34 | ||
| C. | 芹菜中含有的纤维素 | D. | 植物油中含有的油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
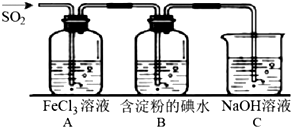
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 乙的常见氧化物有两种 | |
| B. | 气态氢化物稳定性:丙<丁 | |
| C. | 丙的氧化物能与戊的氢化物的水溶液反应 | |
| D. | 原子半径大小:甲>丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
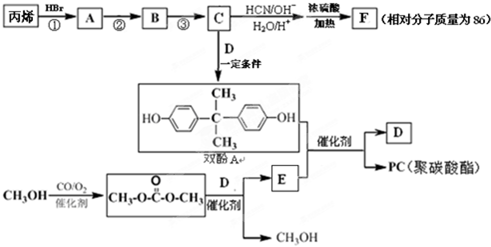
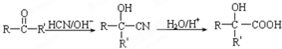
 (R、R′、R″代表羟基)
(R、R′、R″代表羟基) .
.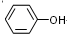 .
. .
.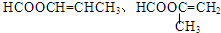 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com