
| A. | 小于7 | B. | 等于7 | ||
| C. | 大于7 | D. | 可能等于7,也可能于小于7或大于7 |
分析 室温下,某碱溶液中水电离出的c(OH-)与某酸溶液中水电离出的c(OH-)相等,说明碱溶液中的c(OH-)与酸溶液中的c(H+)相等,根据酸和碱的强弱性来讨论酸碱混合后的反应情况,据此分析.
解答 解:室温下,某碱溶液中水电离出的c(OH-)与某酸溶液中水电离出的c(OH-)相等,说明碱溶液中的c(OH-)与酸溶液中的c(H+)相等.
①若碱为强碱、酸为强酸,则碱溶液中的c(OH-)与酸溶液中的c(H+)均为两溶液中的全部氢氧根和氢离子,故两者等体积混合后恰好完全反应生成强酸强碱盐,溶液显中性,pH=7;
②若碱为弱碱、酸为强酸,则碱溶液中的c(OH-)是电离出的氢氧根,酸溶液中的c(H+)为溶液中的全部氢离子,故两者等体积混合后,碱过量,溶液显碱性,pH>7;
③若碱为强碱、酸为弱酸,则碱溶液中的c(OH-)为溶液中的全部氢氧根,酸溶液中的c(H+)是电离出的氢离子,故两者等体积混合后酸过量,溶液显酸性,pH<7;
④若碱为弱碱、酸也为弱酸,则根据碱和酸的相对强弱,所得溶液也可能为中性、酸性和碱性.
综上分析可知,溶液混合后pH可能等于7,也可能大于7或小于7,故选D.
点评 本题考查了酸和碱混合后溶液pH的计算,根据酸和碱的强弱来分类讨论,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲溶液含有Ba2+ | B. | 乙溶液不含SO42- | C. | 丙溶液含有HCO3- | D. | 丁溶液含有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+ | B. | HCO3- | C. | Fe3+ | D. | OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属氧化物都不能与酸反应 | B. | 含金属元素的盐溶液一定呈酸性 | ||
| C. | 组成元素相同的盐溶液酸碱性相同 | D. | 非金属元素可能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳棒上放出氯气 | B. | 碳棒上放出氧气 | C. | 碳棒附近产生OH- | D. | 铁钉被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
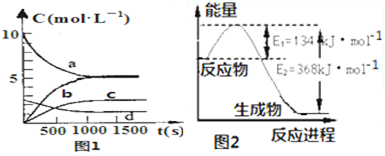
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、Na+、ClO、NO3- | ||
| C. | MnO4-、K+、SO42-、Na+ | D. | Mg2+、NH4+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ④和②混合溶液中:c(H+)=c(OH-) | |
| B. | ①与④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | ②和③混合溶液中:c(H+)>c(OH-) | |
| D. | 四种溶液稀释100倍,溶液pH:③>④>②>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com